
题目列表(包括答案和解析)
12.水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O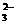 +O2+xOH-
+O2+xOH-
Fe3O4+S4O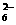 +2H2O,下列说法中正确的是
+2H2O,下列说法中正确的是
A.每生成1mol Fe3O4,反应转移的电子总数为4mol
B.Fe2+和S2O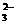 都是还原剂
都是还原剂
C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol
D.x=2
11.下列离子方程式书写正确的是
A.用氨水溶解氯化银沉淀:Ag Cl+2 NH3·H2O=[Ag(NH3)2]+ +2 H2O + Cl-
B.向Ba(OH)2溶液中滴加Na HSO4溶液至刚好沉淀完全:
Ba2++2OH-+2H++SO42-=BaSO4↓+ 2H2O
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2 +2H+=2Fe3++2H2O
D.向次氯酸钠溶液中通入足量SO2气体:ClO-+ SO2+ H2O = HClO+ HSO3-
10.下列离子在溶液中能大量共存,且加入(NH4)2Fe(SO4)2·6H2O晶体后仍能大量存在的是
A.Na+ 、H+ 、Cl- 、NO3- B.K+ 、Ba2+ 、OH- 、I-
C.Na+、 Mg2+ 、Cl- 、SO42- D.Cu2+ 、 S2- 、Br- 、ClO-
9.设阿伏加德罗常数的值为6.02×1023,下列叙述中正确的是
A.2.24L(标准状况)Cl2与足量Ca(OH)2在常温下反应,转移的电子数为1.2 04×1022
B.常温常压下,92gNO2和N2O4混合气体中含有的原子数为3.612×1024
C.12.5 mL 16 mol/L浓硫酸与足量铜共热,可生成SO2的分子数约为6.02×1022
D. 23 g Na和足量的O2完全反应,无论是常温,还是燃烧,都失去6.02×1023个电子
8.浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合后,其质量分数为a%,而等体积混合后,溶液的质量分数为c%,那么a、b、c数值的关系是
A. a>b>c B. b>a>c C. c>b>a D. c>a>b
7.下列有关热化学方程式的叙述中,正确的是
A.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出 28.7 kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)=NaC1(aq)+H2O(l)△H=十57.4 kJ/mol
B.已知C(石墨,s)=C(金刚石,s);△H> 0,则金刚石比石墨稳定
C.已知2H2(g)十O2(g)=2H2O(g);△H=-483.6 kJ/mol,
则H2的燃烧热为 241.8 kJ/mol
D.已知 2C(s)+2O2(g)=2CO2(g);△H1 2C(s)+O2(g)=2CO(g);△H2
则△H1<△H2
6.实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
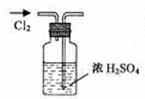
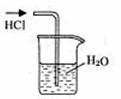
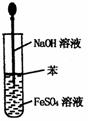
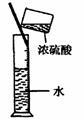
A.干燥Cl2 B.吸收HCl C.制取Fe(OH)2沉淀 D.稀释浓H2SO4
5.生产、生活离不开各种化学物质,下列说法不正确的是
A.不需要通过化学反应就能从海水中获得食盐和淡水
B.潜水艇在紧急情况下可用过氧化钠供氧
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.工业上常用单质硅作为光导纤维;用铝粉还原一些金属氧化物来制金属
4.目前人类已发现的非金属元素除稀有气体外,共有16种。下列对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸
A.只有②③正确 B.只有①③正确
C.只有④正确 D.均不正确
3.下列有关物质类别判别的依据正确的是
A.原子晶体:晶体的熔点是否很高 B.电解质:水溶液是否导电
C.离子化合物:是否含有离子键 D.共价化合物:是否含有共价键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com