
题目列表(包括答案和解析)
9.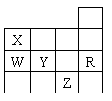 右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
8.已知KH和H2O反应生成H2和KOH,反应中1 mol KH( )
A.失去1 mol电子
B. 得到1 mol电子
C.失去2 mol电子
D. 没有电子得失
A.①②④⑤
B. ②③④⑥
C. ①②④⑥
D. ③④⑤⑥
7.能正确表示下列化学反应的离子方程式是
A 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO-3+SO32-
B 金属铝溶于盐酸中:Al+2H+=Al3++H2↑
C 硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
D 碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
13. 锂离子电池已经成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为:负极反应:C6Li-xe-===C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成复合材料),正极反应:Li1-xMO2+xLi++x e-===LiMO2(LiMO2表示含锂的过渡金属氧化物)。下列有关说法正确的是
A.锂离子电池充电时阴极反应为C6Li1-x+xLi++x e-===C6Li
B.电池反应中,锂、锌、银、铅各失去1 mol电子,金属银所消耗的质量最小
C.锂离子电池放电时电池内部Li+向负极移动
D.锂离子电池充电时电池反应为C6Li+Li1-xMO2===LiMO2+C6Li1-x
12.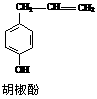 胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;④1 mol该化合物最多可与2 mol Br2发生反应。其中正确的是
胡椒酚是植物挥发油中的一种成分。关于胡椒酚的下列说法:①该化合物属于芳香烃;②分子中至少有7个碳原子处于同一平面;③它的部分同分异构体能发生银镜反应;④1 mol该化合物最多可与2 mol Br2发生反应。其中正确的是
A.①③ B.①②④ C.②③ D.②③④
11.甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
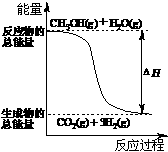 下列说法正确的是
下列说法正确的是
A.CH3OH的燃烧热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:
CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1
10.X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是
A.元素非金属性由弱到强的顺序为Y<Z<X
B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
C.3种元素的气态氢化物中,Z的气态氢化物最稳定
D.原子半径由大到小的顺序为Z>Y>X
9.下列反应的离子方程式正确的是
A.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2OFe(OH)3↓+3H+
B.用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
C.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-Cl2↑+Mn2++H2O
D.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu === Fe2++Cu2+
8.下列实验方案合理的是
A.配制50 g质量分数为5% NaCl溶液:将45 mL水加入到盛有5 g NaCl的烧杯中,搅拌溶解
B.制备乙酸乙酯:用如右图所示的实验装置
C.鉴定SO42-:向溶液中加入盐酸酸化的氯化钡溶液
D.鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到
少量环己烯和苯中
Al2O3
+ N2 + 3C  2AlN + 3CO;
2AlN + 3CO;
下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为-3
D.氮化铝晶体属于分子晶体
7.阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是
A.标准状况下,2.24 L苯中约含有3.612×1023个碳原子
B.常温常压下,氧气和臭氧的混合物16 g中约含有6.02×1023个氧原子
C.25℃时,1 L pH=13的氢氧化钠溶液中约含有6.02×1023个氢氧根离子
 D.0.5 mol CH4中约含有6.02×1024个电子
D.0.5 mol CH4中约含有6.02×1024个电子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com