
题目列表(包括答案和解析)
4.《Inorganic Syntheses》(无机合成)一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是
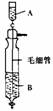 A.A中装浓硫酸,B中装浓盐酸
A.A中装浓硫酸,B中装浓盐酸
B.A中装浓盐酸,B中装浓硫酸
c.A中装氢氧化钠浓溶液,B中装浓氨水
D.A中装浓氨水,B中装氢氧化钠浓溶液
3.下列叙述不正确的是
A.硝酸银溶液通常保存在棕色的试剂瓶中,是因为硝酸银见光易分解
B.乙醇的沸点比甲醚(CH3OCH3)高,主要原因是乙醇分子间能形成氢键
C.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,因为AgBr比AgCl更难溶于水
D. 常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应
2.正电子、负电子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,电性相反。科学家设想在宇宙的某些部分可能存在完全由反粒子构成的物质----反物质。1997年年初和年底,欧洲和美国的科研机构先后宣布:他们分别制造出9个和7个反氢原子,这是人类探索反物质的一大进步。你推测反氢原子的结构是:
A.由1 个带正电荷的质子与一个带负电荷的电子构成
B.由1 个带负电荷的质子与一个带正电荷的电子构成
C.由1 个不带电的中子与一个带负电荷的电子构成
D.由1 个带负电荷的质子与一个带负电荷的电子构成
1.下列解释不科学的是
A.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成了可溶性的Ca(HCO3)2的缘故。
B.长期盛放NaOH溶液的滴瓶不易打开,是因为NaOH与瓶中的CO2反应导致瓶内气
体减少形成“负压”的缘故。
C.严格地讲,“通风橱”是一种不负责任的防污染手段,因为实验产生的有害气体没有得到转化或吸收。
D.“雨后彩虹”、“海市蜃楼,’既是一种自然现象又是光学现象,也与胶体的知识有关。
26、(8分)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液中加入V mL a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为 。
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水 g。
25、(12分)晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
 ①高温下用碳还原二氧化硅制得粗硅
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2
③SiHCl3与过量H2在1000-1100℃反应制得纯硅
已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为____________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
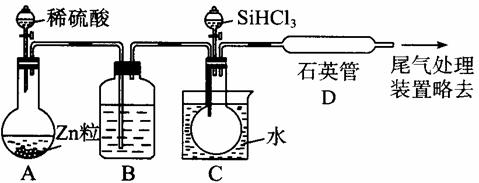
①装置B中的试剂是________________________。(1分)
装置C中的烧瓶需要加热,其目的是____________________________________。(1分)
②反应一段时间后,装置D中观察到有固体生成,装置D不能采用普通玻璃管的原因是:
_______________________________________________________________________(1分);
装置D中发生反应的化学方程式为
___________________________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及______________________________________(1分)
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是_________________。
a. 碘水 b. 氯水 c. NaOH溶液 d. KSCN溶液 e. Na2SO3溶液
24、(14分)21世纪是全世界大规模开发利用海洋资源、发展海洋经济的新时期。为了人类和平利用海洋资源,今年我国环球科学考察船“大洋一号”首次执行环球大洋科学考察任务。海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第 族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经冷却而得高纯度淡水。由此可判断蒸馏法是 (填:物理变化或化学变化)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。该反应的化学方程式为:
利用电解所得气体制36.5%的浓盐酸1000t,最少需消耗食盐 t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫的废气并回收二氧化硫的方法。该方法流程如下:


请写出②反应的离子方程式: ;
④反应的化学方程式 。
(5)上述亚硫酸氢钠与甲醛经过一定反应可以合成俗称“吊白块(雕白粉)”的物质,因该物质对人体有害,不能用于食品漂白。“吊白块”结构简式为:HOCH2SO3Na,根据其结构特点,“吊白块”能发生的反应有 。(填字母)
A.皂化反应 B. 与金属钠反应 C. 氧化反应
23、(8分)A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1∶1和1∶2。高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入NaOH溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式(分子式)是
(2)B煅烧生成C和D的化学方程式是:
甲元素的单质与F溶液反应的离子方程式是:
(3)往G溶液中加入NaOH溶液发生的现象是:
22、含8.0g NaOH的溶液中通入一定量H2S后,将得到的溶液小心蒸干,称得无水物7.9g,则该无水物中一定含有的物质是:
A、Na2S B、NaHS C、Na2S和NaHS D、NaOH和NaHS
21、Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为:
A、1∶7 B、1∶9 C、1∶5 D、2∶9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com