
题目列表(包括答案和解析)

A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示。
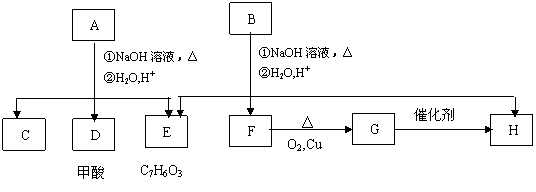
(1)B可以发生的反应类型有(填序号) 。
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
(2)E中含有官能团的名称是 。
(3)A有两种可能的结构,其结构简式为 , 。
(4)B、C、D、F、G化合物中互为同系物的是 。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为
20.(9分)已知硫酸在水中的电离方程式是:H2SO4====H++HSO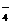 HSO
HSO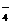
 H++SO
H++SO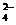 ,回答下列问题:
,回答下列问题:
(1)Na2SO4溶液显 (填“酸性”,“中性”或“碱性”),理由是
(用离子方程式表示)。
(2)在0.1 mol·L-1的Na2SO4溶液中,下列微粒浓度关系不正确的是 。
A.c(SO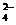 )+c(HSO
)+c(HSO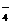 )+c(H2SO4)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HSO
)+c(H2SO4)=0.1 mol·L-1
B.c(OH-)=c(H+)+c(HSO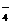 )
)
C.c(Na+)+c(H+)=c(OH-)+c(HSO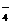 )+2c(SO
)+2c(SO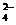 )
D.c(Na+)=2c(SO
)
D.c(Na+)=2c(SO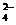 )+2c(HSO
)+2c(HSO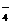 )
)
(3)如果25 ℃时,0.1 mol·L-1的NaHSO4溶液中c(SO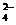 )=0.029 mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO
)=0.029 mol·L-1,则0.1 mol·L-1H2SO4溶液中c(SO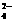 )
0.029 mol·L-1(填“<”,“>”或“=”)。
)
0.029 mol·L-1(填“<”,“>”或“=”)。
(4)0.1 mol·L-1NaHSO4溶液中各种离子浓度由大到小的顺序是: 。
17.(9分)A、B、C、D、E五种短周期元素,原子序数依次增大,已知B元素原子最外层电子数是次外层电子数的两倍,C可分别与A、D形成化合物A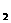 C、A
C、A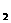 C
C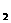 和D
和D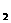 C、D
C、D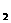 C
C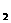 ;E的最外层电子数比最内层电子数多1。请回答:
;E的最外层电子数比最内层电子数多1。请回答:
(1)D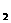 C
C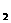 的电子式_______________________。
的电子式_______________________。
(2)B与A_______________(填“能”或“不能”)形成与A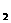 C
C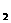 电子总数相等的分子,如果能,化学式是____________(如果不能,此空不用填)。
电子总数相等的分子,如果能,化学式是____________(如果不能,此空不用填)。
(3)请写出实验室制取B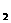 A
A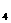 时反应的化学方程式
时反应的化学方程式
(4)E单质可与应用最为广泛的金属的最高价氧化物反应,并生成另一种化合物F,该反应化学方程式是 。
|
18.(8分)在下图所示的转化关系中,A、B、C是中学化学中常见的物质,都含有同一种元素R,且所含元素均在短周期中。回答下列问题。(说明:图中不含R的产物均已略去,反应②的产物之一是A) |
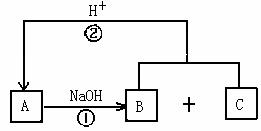 |
(1)若A为两性无机化合物,由A转化为B和C的离子方程式为
.
(2)若A是由非金属元素组成的盐,则由A转化成B(或B、C)的离子方程式为_________________________________________________________________。
(3)若A为酸性氧化物,A与NaOH溶液反应有三种情况(只生成B、只生成C、同时生成B和C),则A为__________________________。
(4)若A可由家庭生活中两种常见的有机物合成,则A转化成B和C的化学方程式为
16.(14分)下列装置图甲是某种不溶于水的气体R的发生装置和收集装置
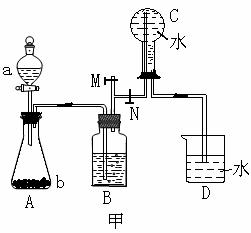
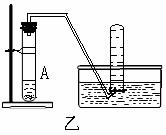
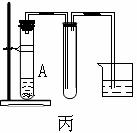
所用的试剂从下列试剂中选取2-3中:二氧化锰、铜片、硫化亚铁、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。(说明:甲装置中M和N为止水夹。)
(1)气体R的化学式是 ;
(2)所选试剂a、b是 ;装置B的作用是
。
(3)如上图所示装置乙和丙中,能代替装置甲的简易装置是 (填“乙”或“丙”),并说明理由: 。
(4)写出在试管A中所发生反应的离子方程式: 。
(5)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量且过量的浓硝酸或稀硝酸反应,所得溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,归纳了两种意见,一种意见是:Cu2+浓度差异引起的,你认为是否正确? (填“正确”或“不正确”),依据是: 。
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并且用试验进行了证明,请简述试验方案与试验现象:
。
15.(2分)白磷的着火点为40oC,在室温或夏天正常取出时,就可观察到其被氧化而冒“白烟”,请简单说明将如何将大块的白磷改变成小块的白磷。
答:
14.将15.6gNa2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶
液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则
A.反应过程中得到6.72L的气体(标准状况)
B.最终得到的溶液中c(Na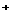 )=c(Cl
)=c(Cl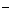 )+c(OH
)+c(OH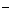 )
)
C.最终得到15.6g的沉淀
D.最终得到的溶液中c(NaCl)=1.5mol/L
高三化学月考试题
第Ⅱ卷(非选择题,共58分)
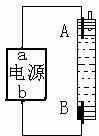
13.某同学设计了一种用电解法制取Fe(OH)2的试验装置如右图。通电后,溶液中产生白色沉淀,且较长时间内不变色,下列说法中正确的是
|
A.电源中a为正极,b为负极 B.电解池中电解液可以是NaOH溶液但不能是NaCl溶液 C.A、B两端都必须使用铁作电极 D.A电极发生的反应为:2H2O + 2e 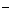 ==H2 ↑+ 2OH ==H2 ↑+ 2OH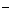 |
 |
12.下列各选项中所述的两个量,前者一定大于后者的是
A.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量
B.pH=10的NaOH和Na2CO3溶液中,水的电离程度
C..物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH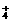 的物质的量浓度
的物质的量浓度
D.相同温度下,10mL 0.1mol/L的醋酸与100mL 0.01mol/L的醋酸中H+的物质的量
11.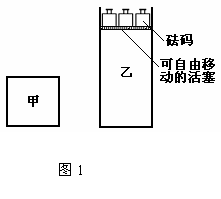 一定温度下,有可逆反应:2A(g)+2B(g)
一定温度下,有可逆反应:2A(g)+2B(g) C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B
C(g)+3D(g);ΔH<0。现将2 mol A和2 mol B
充入体积为V的甲容器,将2 mol C和6 mol D充入乙容器并使乙容器在反应开始前的体积
 为2V(如图1)。
为2V(如图1)。
关于两容器中反应的说法正确的是
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组份的体积百分组成不相同,混合气体平
均相对分子质量也不相同
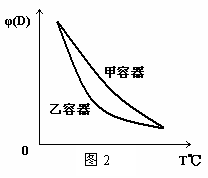
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2 所示
D.在甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的浓度是乙中物质C的浓度的2倍
9.设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温时,2L 1mol/L的乙酸溶液中,所含分子总数大于2NA
B.标准状况下,3.2g铜与足量的浓硝酸反应生成的气体含有的分子数是0.1NA
C.7.8 g Na2O2含有的阴离子数目为0.2 NA
D.在含4 mol Si-O键的石英晶体中,氧原子的数目为4NA
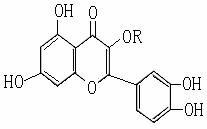
|
10.天然维生素P(结构如右图)存在于槐树花蕾中,它是一种营养增补剂。下列关于维生素P的叙述中错误的是 A.可以和溴水反应 B.可用有机溶剂萃取 C.分子中有三个苯环 D.1mol维生素P可以和4 molNaOH反应 |
 |
8.进行下列实验肯定能获得成功的是
A.用1mol/L的盐酸与MnO2反应制取氯气
B.用湿润的淀粉碘化钾试纸鉴别二氧化氮和溴蒸气
C. 用10mL量筒准确量8.50mL稀硫酸
D.用热的浓纯碱溶液去除管壁内壁附着的油脂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com