
题目列表(包括答案和解析)
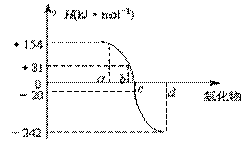
15、(10分)已知:在热力学标准态(298K、1.01×105Pa)下,由稳定的单质发生反应生成1mol化合物的反应热叫该化合物的生成热(△H)。下图为氧族元素氢化物a、b、c、
d的生成热数据示意图。试回答下列问题:
分数 姓名 班级
⑴写出氧族元素中含有18e-的两种氢化物的电子式
。
⑵请你归纳:非金属元素氢化物的稳定性与氢化物的反应热△H的关系
⑶写出硒化氢在热力学标准态下,发生分解反应的热化学反应方程式:
。
14、(9分)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol。某同学用22g液化气(以C3H8计)做实验,测定燃烧放出热量有关数据如下:
①完全燃烧生成CO2和H2O(g)时,放出热量a kJ ;
②不完全燃烧生成CO和H2O(g)时,放出热量b kJ;
③不完全燃烧生成CO、CO2和H2O(g)时,放出热量 c kJ ;
请写出(1)能表示液化气燃烧热的热化学方程式
(2)CO的燃烧热为
(3)第③次实验生成CO的物质的量为
13、(12分)按下列要求写出热化学方程式:
①用CO气体还原1mol氧化铁固体,放热24.8KJ
②1molHgO(S)分解为液态汞和氧气,吸热90.7KJ
③常温下,3molNO2气体溶于水中,生成硝酸和NO气体,放热138KJ
12、(9分)以下是一些烷烃的燃烧热(KJ/mol)数据,试回答下列问题:
|
化合物 |
燃烧热 |
化合物 |
燃烧热 |
|
甲烷 |
891.0 |
正丁烷 |
2878.0 |
|
乙烷 |
1560.8 |
异丁烷 |
2869.6 |
|
丙烷 |
2221.5 |
2-甲基丁烷 |
3531.3 |
⑴已知:物质的能量越高越不稳定,试根据表中有关数据,比较正丁烷、异丁烷的热稳定性:正丁烷 异丁烷。
⑵写出乙烷燃烧的热化学方程式 。
⑶相同质量的烷烃,碳的质量分数越大,燃烧放出的热量 (填“越多”、“越少”、“相同”)。
11、已知31g白磷变成31g红磷放出18.39KJ热量,下列两个反应中: 4P(白磷,s)+5O2(g)=2P2O5(s) △H= -Q1 KJ/mol 4P(红磷,s)+5O2(g)=2P2O5(s) △H= -Q2 KJ/mol Q1和Q2的关系为( ) A. Q1>Q2 B. Q1=Q2 C.Q1<Q2 D.无法确定
第Ⅰ卷 选择题 答案卡
第Ⅱ卷(非选择题 共56分)
10、已知如下两个热化学方程式C(s)+O2(g)===CO2(g);△H==-393.5kJ/mol
2H2(g)+O2(g)===2H2O(g);△H===-483.6 kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是 ( )
A.1:1 B.l:2 C.2:3 D.3:2
9、已知下列热化学方程式:
① CH3CHOOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1=-870.3kJ·mol-1
② C(s)+O2(g)=CO2(g) △H2=-393.5kJ·mol-1
③ H2(g)+1/2O2(g)=H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的焓变为( )
A、-488.3kJ·mol-1 B、-224.15kJ·mol-1 C、488.3kJ·mol-1 D、244.15kJ·mol-1
8.下列有关热化学方程式的叙述正确的是( )
A.已知2H2(g)+O2(g) 2H2O(g)△H=
-483.6 kJ·
mol-1,则氢气的燃烧热为241.8kJ
2H2O(g)△H=
-483.6 kJ·
mol-1,则氢气的燃烧热为241.8kJ
B.已知C(石墨,s) C(金刚石,s)△H>0,则金刚石比石墨稳定
C(金刚石,s)△H>0,则金刚石比石墨稳定
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(ag)+HCl(aq) NaCl(aq)+H2O(l)△H=-57.4 kJ·
mol-1
NaCl(aq)+H2O(l)△H=-57.4 kJ·
mol-1
D.己知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
7、已知:101kPa时的辛烷的燃烧热为5518kJ·mol-1,强酸与强碱在稀溶液中发生反应时的中和热57.3kJ·mol-1,则下列热化学方程式书写正确的是( ) ①C8H18(l)+ 25/2 O2(g)=8CO2(g)+9H2O(l) △H=+5518kJ·mol-1 ②C8H18(l)+ 25/2 O2(g)=8CO2(g)+9H2O(l)△H=-5518kJ·mol-1 ③H++OH-=H2O △H=-57.3kJ·mol-1 ④NaOH(aq)+1/2 H2SO4(aq)= 1/2 Na2SO4(aq)+H2O(l)△H=+57.3kJ·mol-1 A.①③ B.②③ C.②④ D.只有②
6、1g 氢气在氧气中完全燃烧生成气态水,放出热量120.9 kJ,则 ( ) A.反应的热化学方程式:2H2(g)+O2(g)=2H20(g);ΔH=+483.6 kJ·mol一1 B.氢气的燃烧热为241.8 kJ·mol-1 C.1 mol H20(1)的能量大于1 mol H20(g)的能量 D.2 mol H2和1 mol 02的能量总和大于2 mol H2 0(g)的能量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com