
题目列表(包括答案和解析)
1.下列物质的水溶液能导电,但属于非电解质的是
( )
A.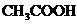 B.
B.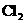 C.
C.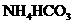 D.
D.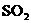


27.(10分)氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮原子核外电子运动状态共有_____种,L层P电子比S电子多____个
(2)砷原子核外电子排布式为________________________________________
(3)K3[Fe(CN)6]晶体中Fe3+与CN-之间的键型为_________________,该化学键能够形成的原因是________________________________
|
|
CH4 |
SiH4 |
NH3 |
PH3 |
|
沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
|
分解温度(K) |
873 |
773 |
1073 |
713.2 |
(4)已知:
分析上表中四种物质的相关数据,请回答:
① CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是____________________________
② CH4和SiH4比较,分解温度高低的原因是________________________
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时__________先液化。
(5)氮化碳结构如右图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。
 ①写出氮化碳的化学式_________
①写出氮化碳的化学式_________
②指出氮化碳的晶体类型_________
26.(10分)1,3-丙二醇是生产新型高分子材料PTT的主要原料,目前1,3-丙二醇的生产的路线有:以石油裂解气为原料的两条石化合成路线和一条生物工程法合成路线。
[路线1]丙烯醛水合氢化法: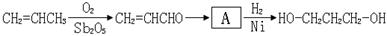
[路线2]环氧乙烷甲酰化法: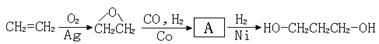
[路线3]生物发酵法:
(1)A的结构简式为
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是 (填1、2或3),理由是_
(3)以1,3-丙二醇与对苯二甲酸为原料可以合成聚酯PTT,写出其化学方程式 。
(4)已知丙二酸二乙酯能发生以下反应:
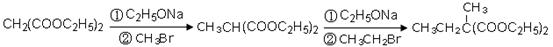
 利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成
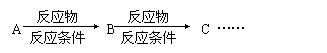
利用该反应原理,以丙二酸二乙酯、1,3-丙二醇、乙醇为原料合成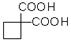 ,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
25、(9分)2008年诺贝尔化学奖授予日本科学家下村修、美国科学家马丁·沙尔菲与美籍华裔科学家钱永健,以表彰三人因在发现和研究绿色荧光蛋白方面做出的贡献。蛋白质是一类复杂的含氮化合物,每种蛋白质都有其恒定的含氮量[约在14%~18%(本题涉及的含量均为质量分数)],故食品中蛋白质的含量测定常用凯氏定氮法。其测定原理是:
Ⅰ.蛋白质中的氮(用氨基表示)在强热和CuSO4、浓H2SO4作用下,生成(NH4)2SO4。
Ⅱ.(NH4)2SO4在凯氏定氮器中与碱作用,蒸馏释放出NH3,收集于H3BO3溶液中,生成(NH4)2B4O7。
Ⅲ.用已知浓度的HCl标准溶液滴定,根据HCl消耗的量计算出氮的含量,然后乘以相应的换算系数,即得蛋白质的含量。
(1)上述原理第Ⅱ步生成(NH4)2B4O7的离子方程式为: __________________。(2分)
(2) 乳制品的换算系数为6.38,即若检测出氮的含量为1%,蛋白质的含量则为6.38%。
不法分子通过在低蛋白含量的奶粉中加入三聚氰胺来“提高”奶粉中的蛋白质含量,导致许多婴幼儿肾结石。
①三聚氰胺的结构如图所示,其化学式为____ ,含氮量(氮元素的质量分数)为____;(各1分)
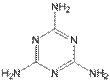 ②下列关于三聚氰胺的说法中,正确的有_____(填序号,多选扣分);(3分)
②下列关于三聚氰胺的说法中,正确的有_____(填序号,多选扣分);(3分)
A. 三聚氰胺是一种白色结晶粉末,没有什么气味和味道,
所以掺入奶粉后不易被发现
B. 三聚氰胺熔沸点高
C. 三聚氰胺不溶于水,属于分子晶体
D. 三聚氰胺呈弱碱性,可以和酸反应生成相应的盐
E. 采用三聚氰胺制造的食具一般都会标明“不可放进微波炉使用”
F. 三聚氰胺分子中所有原子可能在同一个平面上
③假定奶粉中蛋白质含量为16%即为合格,不法分子在一罐总质量为500g、蛋白质含量为0的假奶粉中掺入________g的三聚氰胺就可使奶粉“达标”。(2分)
24、(11分).某工厂以天然气、水蒸气和空气为原料合成氨的流程如下:
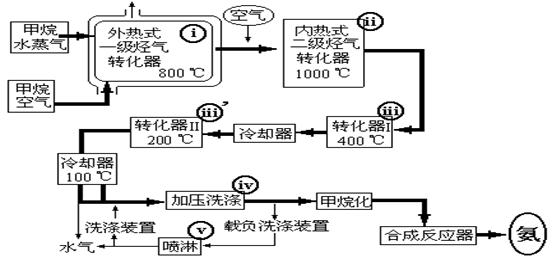
上述流程中外热式一级烃转化器:是指以CH4为燃料在烃气转化器外面加热使之维持800℃高温的工业装置。内热式二级烃气转化器:是指以H2在装置内燃烧为能量维持一级烃气转化器所生成的CO与H2O(气)反应生成CO2和H2所需1000℃高温的装置。 在编号为i-v的反应器中发生如下反应:
(a)CH4+2O2=CO2+2H2O (b)CH4+H2O(g)=CO+3H2 (c)2CH4+3H2O(g)=CO+CO2+7H2
(d)K2CO3+CO2+H2O=2KHCO3 (e)2H2+O2=2H2O(g) (f)CO+H2O(g)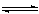 CO2+H2 △H<0
CO2+H2 △H<0
(1)填写下列空白:
甲:反应(a)发生在编号为 的反应器中,它的作用是
乙:反应(e )发生在编号为 的反应器中,它的作用是
丙:属于制备合成氨原料气的反应有(填编号) ,反应(d)的作用是
(2)为什么转化反应要分两步--第一步在400℃时进行,第二步在200℃时进行?
(3)在一定温度和压强的密闭合成反应器中, H2和N2混合气体平均相对分子质量为8.5,当该反应达到平衡时,测出平衡混合气的平均式量为10,请计算此时H2的转化率(写出计算过程):
23.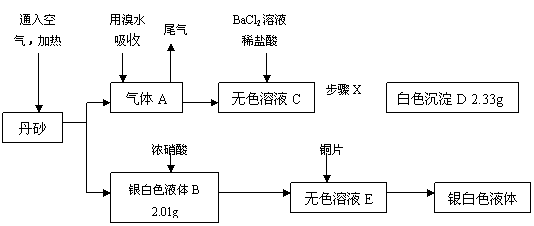 (12分)我国古代道士炼丹时得到了一种红色的丹砂,被他们认为是长生不老的灵丹妙药,曾献给皇上服用,结果……。某学校化学课外活动小组在资料上得到了丹砂是由两种元素组成的化合物。为探究丹砂的成分,他们称取w g丹砂并设计出了下列实验方案:
(12分)我国古代道士炼丹时得到了一种红色的丹砂,被他们认为是长生不老的灵丹妙药,曾献给皇上服用,结果……。某学校化学课外活动小组在资料上得到了丹砂是由两种元素组成的化合物。为探究丹砂的成分,他们称取w g丹砂并设计出了下列实验方案:

请回答下列问题:
(1)w= g;丹砂的化学式是 。
(2)指出丹砂中原子序数较小的元素在周期表中的位置: 。
(3)步骤X是一组系列操作,它们是: 。
(4)写出下列转化的离子反应方程式:
A→C: ;
B→E: 。
(5)另外一组化学课外活动小组也分析并试做了上述实验,但试做时得到的白色沉
淀D 的质量小于2.33g,请你帮助他们分析导致这一结果的原因可能是(至少两个):① ;
② 。
22.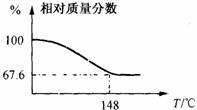 (11分)Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合)可消毒、漂白或作O2源…。现称取一定质量的晶体加热。实验结果以温度和相对质量分数示于右图。
(11分)Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合)可消毒、漂白或作O2源…。现称取一定质量的晶体加热。实验结果以温度和相对质量分数示于右图。
(1).写出棒状晶体的组成。
(2).有人认为Na2CO3·H2O2(x=1时)其实是Na2CO4·H2O(Na2CO4叫做过氧碳酸钠, Na2CO41000OC以上才分解)。请你设计一个实验证明该结论的正确性。(只要求简述实验原理)
(3).国外的洗衣粉中常常加入适量的Na2CO4以提高洗涤质量。加入Na2CO4的作用________________________________。试用化学方程式表示上述洗涤原理__________________ 。(4).有人认为过氧碳酸钠可代替Na2O2,在神七航天仓供氧系统中使用 ,用化学方程式表示其反应原理________________________________________________________________________。
过氧碳酸钠代替Na2O2在航天仓中使用最大的不足是________________________________。
(5).①Na2CO4与稀酸反应的离子方程式__________________________。
②Na2CO4与SO2反应的化学方程式_________________________________.
21.(12分)某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀
碘化亚铁溶液中,加入1-2滴氯水,振荡后溶液呈黄色。请回答下列问题:
(1)探究课题:Fe2+、I- .
(2)猜想:
①甲同学认为还原性:Fe2+= I-,故上述实验现象:溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为还原性:Fe2+> I-,故上述实验现象:溶液呈黄色是含 所致。
③丙同学认为还原性:I-> Fe2+,故上述实验现象:溶液呈黄色是含 所致。
(3)实验设计
丁同学为了得出正确结论,选用下列某些试剂设计出两种方案进行实验供选用的试剂:
a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丁同学选用的试剂、实验中观察到的现象及结论。(试剂填序号)
|
|
选用试剂 |
实验现象 |
结论 |
|
方案1 |
|
|
|
|
方案2 |
|
|
(4)应用与拓展:
①在足量的稀溴化亚铁溶液中,加入1~2滴氯水,溶液呈黄色所发生的离子反应方程式为
②在100mL碘化亚铁溶液中通入2.24L Cl2(标准状况),溶液中有1/3的Fe2+被氧化成单质Fe3+,则原碘化亚铁溶液的物质的量浓度为
20.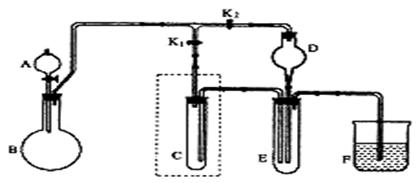 (11分)某学校化学课外活动小组的同学设计了如图所示的实验装置(夹持仪器略),并用其进行下述实验:
(11分)某学校化学课外活动小组的同学设计了如图所示的实验装置(夹持仪器略),并用其进行下述实验:
实验1:制取并收集H2和Cl2
①若制取并收集H2,则旋塞K1应该 (填“打开”或“关闭”),旋塞K2应该 (填“打开”或“关闭”),
② 若将试管C中加满某种液体,可用于收集Cl2,这种液体最好选用 (填编号)。
A.浓硫酸 B.饱和NaHCO3溶液 C.饱和NaCl溶液 D.NaOH溶液
实验2:验证酸性HCl>H2CO3>HClO
①若可供选择的试剂有大理石、盐酸、次氯酸钙等,在干燥管D中加入混有足量NaHCO3的石棉绒,则盐酸应该装入 (填表示仪器的英文字母)中,E仪器内发生反应的离子方程式是
②在干燥管D中加入混有足量NaHCO3的石棉绒的作用是
实验3:用干、湿两个有色布条验证干燥Cl2不具有漂白性而潮湿的Cl2具有漂白性
①若用高锰酸钾与浓盐酸反应制取Cl2,实验前先将装置C改装,试画出改装C的装置图:_________; D中加入 (填代号)
a. 浓硫酸 b. 碳酸氢钠 c.碱石灰 d.氯化钙
②润湿的有色布条应放在 (填表示仪器的英文字母)中。
19.(11分)Ⅰ.下列实验操作或对实验事实的描述不正确的是 (填序号)
①配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高.
②向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体.
③仅用蒸馏水可鉴别出蔗糖、硫酸铜、碳酸钙三种粉末.
④用瓷坩埚熔化各种钠的化合物.
⑤实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉.
⑥测溶液大致的pH:用玻璃棒蘸取溶液滴在湿润的pH试纸上,与标准比色卡对照;
⑦ 向NaOH溶液中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加NaOH溶液现象不同.
 ⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多。
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积前者少,后者多。
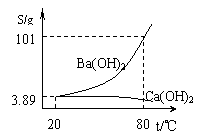
Ⅱ. 实验室有一份混有少量碳酸钙杂质的碳酸钡样品。
分离并提纯碳酸钡的实验步骤如下:
请根据要求填空(右图为Ba(OH)2和Ca(OH)2的溶解度曲线):
(1)高温灼烧碳酸钡和碳酸钙的混合物,直至完全分解。所需仪器除三脚架、泥三角、酒精喷灯、坩埚外还有所需仪器有 、 。
(2)将灼烧后的固体混合物置于80 ℃的热水中,制成氢氧化钡的热饱和溶液。为减少Ba(OH)2的损失并除去不溶物应进行的操作是
(3)将“(2)”中滤液 并过滤,得到的Ba(OH)2固体溶于水制成溶液。
(4)使Ba(OH)2全部生成碳酸钡沉淀的方法:_____________
(5)滤出碳酸钡沉淀,经 后即得到纯净的碳酸钡。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com