
题目列表(包括答案和解析)
18.用酸性氢氧燃料电池电解苦卤水 (含Cl―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
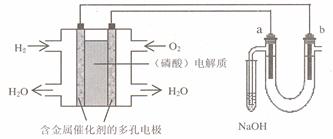
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-=4 OH―
B.电解时,a 电极周围首先放电的是Br―而不是Cl―,说明当其它条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.当电池中消耗0.02g H2 时,b 极周围一定会产生0.02g H2
17.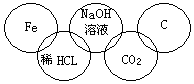 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应。你认为“五连环”中物质间发生的反应,没有涉及的基本反应类型和属于氧化还原反应的个数有
A、复分解反应、1个 B、分解反应、2个
C、化合反应、3个 D、置换反应、2个
16. 用惰性电极电解一段时间后(溶质都有剩余),甲、乙两池串联且甲乙两池中溶液的pH变化趋势相同,且两阳极、两阴极的反应产物的物质的量分别相等的是
|
|
A |
B |
C |
D |
|
甲 池 |
H2SO4(aq) |
CuCl2(aq) |
HCl(aq) |
NaOH(aq) |
|
乙 池 |
AgNO3(aq) |
K2SO4(aq) |
NaCl(aq) |
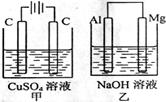 CuSO4(aq) CuSO4(aq) |
15.已知某饱和溶液的:①溶液的质量;②溶剂的质量;③溶液的体积;④溶质的摩尔质量;⑤溶质的溶解度;⑥溶液的密度。从以上条件的组合中不能用来计算该饱和溶液的物质的量浓度的是:
A、①③④ B、④⑤⑥ C、①②③④ D、①③④⑤
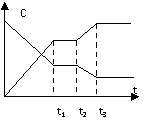
14.反应X(g)+Y(g)  2Z(g),△H<0,从反应开始经t1 S达到平衡状态。在t2 S末由于条件变化,平衡受到破坏,在t3 S时达到新的平衡,右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中t2-t3间的曲线变化是由于哪种条件的改变引起的
2Z(g),△H<0,从反应开始经t1 S达到平衡状态。在t2 S末由于条件变化,平衡受到破坏,在t3 S时达到新的平衡,右图表示上述反应过程中物质的浓度与反应时间的变化关系,图中t2-t3间的曲线变化是由于哪种条件的改变引起的
A、增大X或Y的浓度 B、增大压强
C、增大Z的浓度 D、降低温度
13.NO + O2 + NO2 +H2O - HNO3(未配平),是多组化学计量数的化学方程式。当氧气有1/3被NO还原时,此反应中各化学计量数之比为
 A.4∶9∶24∶14∶28 B.1∶1∶1∶1∶2
A.4∶9∶24∶14∶28 B.1∶1∶1∶1∶2
C.8∶9∶12∶10∶20 D.任意比均可
12.下列叙述不正确的是
A.能抑制水的电离的物质可以是酸、碱或某些盐.
B.晶体硅熔化时虽然共价键被破坏,但属于物理变化.
C.由两种元素形成的共价化合物中,可能存在非极性共价键.
D.元素的非金属性越强,相应的氢化物越稳定,氢化物水溶液酸性也越强.
11.在第n电子层中,当它作为原子的最外层时容纳最多电子数与第(n-1)层相同; 当它作为原子的次外层时,其电子数比(n-1)层多10个,则对此电子层的判断正确的是
A.必为K层 B.只能是L层 C.只能是M层 D.可以是任意层
10.在相同的温度和压强下,4个容器中分别装有4种气体。已知各容器中的气体和容器的容积分别是a.CO2,100mL;b.O2;200mL;c.N2,400mL;d.CH4,600mL。则4个容器中气体的质量由大到小的顺序是
A.a>b>c>d B.b>a>d>c C.c>d>b>a D.d>c>a>b
9. 升高温度,下列数据不一定同时增大的是
A.化学反应速率v B.弱电解质的电离平衡常数Ka
C.化学平衡常数K D.水的离子积常数Kw
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com