
题目列表(包括答案和解析)
6. 在含有1mol KAl(SO4)2的溶液中逐滴加入含有2mol Ba(OH)2的溶液,下列有关说法中正确的是( )
A.先生成沉淀,后沉淀全部溶解
B.当溶液中A13+全部沉淀出来时,沉淀的总物质的量最大
C.当溶液中A13+全部沉淀出来时,沉淀质量开始减少
D.最后的沉淀为2mol BaSO4,1mol Al(OH)3
5. 下列离子方程式书写正确的是( )
A.在碘化亚铁溶液中通入足量氯气:
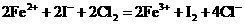
B.用铜电极电解氯化钠饱和溶液:
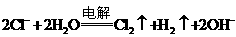
C.向硫酸亚铁溶液中通入H2S气体: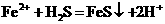
D.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2++H2O2+2H+=2Fe3++2H2O
4. 有a、b、c、d、e五种金属。已知(1)e的氧化产物比d的氧化产物氧化能力强;(2)a投入e的盐溶液中可得e的单质,而c投入e的盐溶液中却不能可得e的单质;(3)在以a、d为极板形成的原电池中(电解质溶液是稀硫酸),d极上发生还原反应;(4)电解含有a、b、c、e阳离子的盐溶液时,b离子最先在电极上放电,然后是e离子,a、c两种离子则不能在电极上放电;(5)c的单质与硫酸铜溶液反应可生产蓝色沉淀。推知五种金属的活动顺序为 ( )
A.a、d、b、e、c B.c、a、d、e、b
C.a、e、d、b、c D.c、a、b、e、d
3. 向含有amolAlCl3的溶液中加入bmol NaOH 溶液,观察到的现象是先有白色沉淀,后沉淀部分溶解,则生成Al(OH)3沉淀的量是 ( )
A.a mol B.(4a-b)mol C.bmol D.(4b-a)mol
2. 下列各组离子在相应的条件下一定能大量共存的是( )
A.与铝粉反应放出氢气的无色溶液中:NO3-、Mg2+、Na+、SO42-
B.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、C1-、K+
C.水电离出的c(H+)=1×10-13mol/L的溶液中,K+、CO32-、Cl-、S2-
D.在pH=3的无色溶液中:Fe3+、C1-、NO3-、A13+
1. 化学中物质很多反应不仅与反应物质本身性质有关,还与物质的浓度、反应温度和反应物的用量等条件有关。下列各组物质:
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液
④Fe与HCl溶液 由于浓度不同而能发生不同氧化还原反应的是
A.①③ B.③④ C.①② D.①③④
22.(16分)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设
假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 试剂。
⑴若假设1成立,则实验现象是 。
⑵若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗? ,简述你的理由(不需写出反应的方程式 ) 。
⑶若固体粉末完全溶解无固体存在 , 滴加 KSCN 试剂时溶液不变红色 , 则证明原固体粉末是 ,写出实验过程中发生的氧化还原反应的离子方程式 。
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
⑷实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为 。
⑸某铝土矿样品经测定是由Al2O3、Fe2O3、 FeO、 SiO2等氧化物组成,请设计一简单实验,确定矿物中含有+2价的铁(写出所用试剂,操作方法和结论)。
21.(10分)某研究性学习小组为研究Cu与浓H2SO4的反应,设计如下实验探究方案(装置中的固定仪器和酒精灯均未画出)。
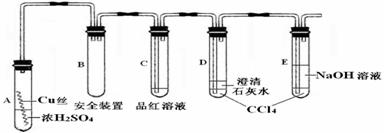 实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
实验选用细铜丝、98.3%H2SO4、品红溶液、澄清石灰水、CCl4、NaOH溶液等药品,铜丝被卷成螺旋状,一端没入浓H2SO4中,另一端露置在液面上方。
以下是该学习小组部分交流记录及后续探究实验的记录。
材料一:小组交流摘录
学生1:加热前,无现象发生;加热后,液面下铜丝变黑,产生气泡,有细小黑色颗粒状物质从铜丝表面进入浓硫酸中,黑色物质是什么?值得探究!
学生2:加热后,我也观察到黑色颗粒状物质,后来逐渐转变为灰白色固体,我想该灰白色固体极有可能是未溶于浓硫酸的CuSO4。
学生3:你们是否注意到液面以上的铜丝也发黑,而且试管上部内壁有少量淡黄色S固体凝聚,会不会液面以上的铜丝与硫发生了反应,我查资料发现:2Cu+S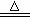 Cu2S(黑色)。
Cu2S(黑色)。
材料二:探究实验剪辑
实验1:将光亮的铜丝在酒精灯火焰上灼烧变黑,然后插入稀硫酸中,铜丝重新变得光亮,溶液呈蓝绿色;将光亮的铜丝置入加热的硫蒸气中变黑,然后插入稀硫酸中无变化。
实验2:截取浓硫酸液面上方变黑的铜丝,插入稀硫酸中无变化;将浓硫酸液面下方变黑的铜丝,插入稀硫酸,黑色明显变浅,溶液呈蓝绿色。
实验3:将溶液中的黑色颗粒状物质,经过滤、稀硫酸洗、蒸馏水洗、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现质量减少10%左右。
根据上述材料回答下列问题:
(1)A试管上方的长导管的作用是 ;D、E两支试管中CCl4的作用是 。
(2)加热过程中,观察到A试管中出现大量白色烟雾,起初部分烟雾在试管上部内壁析出淡黄色固体物质,在持续加热浓硫酸(沸腾)时,淡黄色固体物质又慢慢地消失。写出淡黄色固体消失的化学反应方程式: 。
(3)对A试管中的浓H2SO4和铜丝进行加热,很快发现C试管中品红溶液褪色,但始终未见D试管中澄清石灰水出现浑浊或沉淀。你的猜想是: 。
(4)根据上述研究,结合所学知识,你认为液面下方铜丝表面的黑色物质成分是 (写化学式)。
20.(6分) A、B、C、D均为中学化学所学的常见物质,且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其它产物已略去):
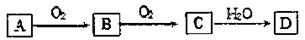
请填写下列空白:
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,则D为(填写化学式) 。
(2)若A为气体,其水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使湿润的蓝
色石蕊试纸变红。则工业上合成A的化学方程式为 。
(3)若A为短周期元素的形成的非金属单质,则A可能是
(填3种不同单质的化学式)。
19.(14分)在足量的氯化亚铁稀溶液中,加入1-2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因有两种猜测。
(1)猜测1:溶液呈黄色不是发生化学反应所致,黄色是溶液中含有 引起的(填微粒的化学式)。要证明溶液中确有该物质,可在该溶液中加入 ,观察到 现象。
(2)猜测2:溶液呈黄色是发生化学反应所致,则黄色是溶液中 引起的,反应的离子方程式为 。要证明溶液中确有该物质,可在溶液中加入 ,观察到 现象。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com