
题目列表(包括答案和解析)
8.由H2SO4、Al2O3、NaOH、Mg、Cl2两两之间进行反应,可制得的正盐有
A.5种 B.6种 C.7种 D.8种
7.某溶液中含有SO42- 、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1∶2∶4,则离子M可能是
、CO32-、NH4+、M,且SO42-、CO32-、NH4+离子的物质的量之比为1∶2∶4,则离子M可能是
A.H+ B.K+ C.Cl- D.Ba2+
6.向饱和澄清石灰水中加入生石灰,再恢复到原温度,下列说法正确的是
A.Ca2+浓度减小 B.溶剂质量减小
C.溶液质量不变 D.Ca2+数目增多
5.下列关于实验的描述不正确的是()
A.使用容量瓶配制溶液时,俯视液面定容后所 得溶液的浓度偏低
得溶液的浓度偏低
B.过滤时,玻璃棒靠在三层滤纸边沿稍下方
C.在镀件上电镀铜时,可用金属铜作阳极
D.在用Fe(OH)3胶体溶液做电泳实验时,阴极区红色加深,可知Fe(OH)3胶体粒子带正电荷
4.下列实验操作正确的是
A.用带橡皮塞的棕色细口瓶盛放浓硝酸
B.滴定管经蒸馏水润洗后,即可注入标准液进行滴定
C.用干燥清洁的玻璃棒蘸取某溶液点在pH试纸中部,跟标准比色卡比较来测定该溶液的pH
D.配制溶液时加水超过容量瓶的标线,用滴管把多余的液体吸出
3.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的晶体类型为 ()
A.原子晶体 B.分子晶体 C.离子晶体 D.金属晶体
2.下列化学用语表达正确的是
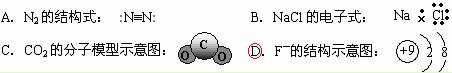
1.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为: ()
2Ag+Zn(OH)2 Ag2O+Zn+H2O
Ag2O+Zn+H2O
在此电池放电时,负极上发生反应的物质是.
A.Ag B.Zn(OH)2  C.Ag2O D.Zn
C.Ag2O D.Zn
59.
 答案
答案 :(1)FeS2
:(1)FeS2


 (2)
(2)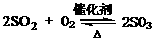


 (3)a b d
(3)a b d


 (4)SO3(g) + H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol
(4)SO3(g) + H2O(l) = H2SO4(l);ΔH=-130.3kJ/mol


 (5)①SO2 + Br2 + 2H2O = 4H+ + 2Br-
+ SO42-
(5)①SO2 + Br2 + 2H2O = 4H+ + 2Br-
+ SO42-


 ②14.56 2.31g
②14.56 2.31g




 解析:本题主要考查硫酸工业、热化学方程式的书写、计算等。
解析:本题主要考查硫酸工业、热化学方程式的书写、计算等。

 (1)根据原子守恒即可判断该物质为FeS2。
(1)根据原子守恒即可判断该物质为FeS2。






 (2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2
(2)SO2和O2在接触室发生反应生成SO3:2SO2 + O2
 2SO3。
2SO3。

 (3)选项a,将黄铁矿粉碎更增加反应接触面积而加快反应速率。选项b,增加空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。
(3)选项a,将黄铁矿粉碎更增加反应接触面积而加快反应速率。选项b,增加空气(O2)浓度能提高SO2的转化率。选项c,催化剂对转化率无影响。选项d,矿渣中含有Fe2O3,可用于冶炼铁。

 (4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。
(4)160g SO3(g)与H2O(l)反应生成H2SO4(l)放出260.6kJ热量,则1mol SO3(g)与H2O(l)反应生成H2SO4(l)放出130.3kJ热量,则相关热化学方程式为: SO3(g) + H2O(l)=H2SO4(l);△H=-130.3kJ/mol。

 (5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L
(5)10g时说明铵盐不足,20g时说明氢氧化钠不足,由10.00g和20.00g 时浓硫酸增加的质量相同说明铵盐有酸式根产生的氨气, 氢氧化钠的物质的量浓度为Cmol/L

 设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则
设10克中有Xmol的 (NH4)2SO4 和ymol的NH4HSO4则

 132X + 115y=10…………………………………………………….(1)
132X + 115y=10…………………………………………………….(1)

 10g时说明铵盐不足由N守恒知
10g时说明铵盐不足由N守恒知

 n(NH3)=2X + y
n(NH3)=2X + y

 20g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2Xmol,2ymol的NH4HSO4
20g时铵盐已经过量,氢氧化钠先和酸式根反应,则(NH4)2SO4为2Xmol,2ymol的NH4HSO4

 HSO4- + OH- = SO42- + H2O
HSO4- + OH- = SO42- + H2O

 1 1
1 1

 2y 2y
2y 2y

 NH4+ + OH- = NH3 +
H2O
NH4+ + OH- = NH3 +
H2O

 1
1
1
1

 50C×10-3-2y 50C×10-3-2y
50C×10-3-2y 50C×10-3-2y

 由于产生的氨气一样多
由于产生的氨气一样多

 n(NH3)=2X
+ y=50C×10-3-2y………………………………….(2)
n(NH3)=2X
+ y=50C×10-3-2y………………………………….(2)

 30g时铵盐过量,则(NH4)2SO4为3Xmol,3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol
30g时铵盐过量,则(NH4)2SO4为3Xmol,3ymol的NH4HSO4 n(NH3)=0.68/17=0.04mol

 HSO4- + OH- = SO42- + H2O
HSO4- + OH- = SO42- + H2O

 1 1
1 1

 3y 3y
3y 3y

 NH4+
+ OH- =
NH3
+ H2O
NH4+
+ OH- =
NH3
+ H2O

 1
1
1
1

 50C×10-3-3y
0.04
50C×10-3-3y
0.04

 所以
所以

 50C×10-3-3y=0.04…………………………………………………….(3)
50C×10-3-3y=0.04…………………………………………………….(3)

 联立(1) (2) (3)解得
联立(1) (2) (3)解得

 X=0.02mol
y=0.064mol
C=4.64mol/L
X=0.02mol
y=0.064mol
C=4.64mol/L

 氮的质量百分含量=
氮的质量百分含量= 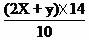 ×100%=(0.04+0.064) ×14/10×100%=14.56%
×100%=(0.04+0.064) ×14/10×100%=14.56%

 15g时铵盐已经过量,则(NH4)2SO4为1.5Xmol,1.5 ymol的NH4HSO4
15g时铵盐已经过量,则(NH4)2SO4为1.5Xmol,1.5 ymol的NH4HSO4

 HSO4- + OH- = SO42- + H2O
HSO4- + OH- = SO42- + H2O

 1
1
1
1

 1.5y 1.5y
1.5y 1.5y

 NH4+
+ OH- =
NH3
+ H2O
NH4+
+ OH- =
NH3
+ H2O

 1
1
1
1

 50C×10-3-1.5y 50C×10-3-1.5y
50C×10-3-1.5y 50C×10-3-1.5y

 n(NH3)= 50C×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136mol
n(NH3)= 50C×10-3-1.5y=50×4.64×10-3-1.5×0.064=0.136mol

 m(NH3)=0.136×17=2.31g
m(NH3)=0.136×17=2.31g
58.
 答案.
答案.  (1)Fe + 2Fe3+
= 3Fe2+
(1)Fe + 2Fe3+
= 3Fe2+


 (2)加入硫酸,H+浓度增大,使Fe2+ +
2H2O
(2)加入硫酸,H+浓度增大,使Fe2+ +
2H2O Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
Fe(OH)2 + 2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解


 (3)Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O
(3)Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O


 4FeCO3 + 6H2O + O2
= 4Fe(OH)3 ↓+ 4CO2
4FeCO3 + 6H2O + O2
= 4Fe(OH)3 ↓+ 4CO2


 (4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净


 (5)288.0
(5)288.0

 解析:本题考查化学实验基本操作、物质的制备、化学反应原理、计算等。(1)Fe3+具有氧化性,能氧化Fe生成Fe2+:2Fe3+ + Fe=3Fe2+。
解析:本题考查化学实验基本操作、物质的制备、化学反应原理、计算等。(1)Fe3+具有氧化性,能氧化Fe生成Fe2+:2Fe3+ + Fe=3Fe2+。

 (2)由于Fe2+水解,加入H2SO4可阻止其水解。
(2)由于Fe2+水解,加入H2SO4可阻止其水解。

 (3)Fe2+与HCO3―在溶液中发生双水解生成FeCO3:Fe2+ + 2HCO3―=FeCO3↓+
CO2↑+
H2O。FeCO3在被O2氧化最终生成Fe(OH)3而出现红褐色:4FeCO3 + O2 + H2O=Fe(OH)3 ↓+ 4CO2↑。
(3)Fe2+与HCO3―在溶液中发生双水解生成FeCO3:Fe2+ + 2HCO3―=FeCO3↓+
CO2↑+
H2O。FeCO3在被O2氧化最终生成Fe(OH)3而出现红褐色:4FeCO3 + O2 + H2O=Fe(OH)3 ↓+ 4CO2↑。

 (4)SO42―的检验一般采用BaCl2溶液,根据溶液与BaCl2溶液反应是否有白色沉淀产生来判断溶液中是否存在SO42―。
(4)SO42―的检验一般采用BaCl2溶液,根据溶液与BaCl2溶液反应是否有白色沉淀产生来判断溶液中是否存在SO42―。

 (5)464kg FeCO3中含有Fe元素4×103mol,设产品中FeO xmol ,Fe2O3ymol,则有:x + 2y=4×103,72x + 160y=316.8×103,解得x=2.2×103mol,y=1.8×103mol,故Fe2O3的质量=1.8×103mol×160g/mol=288.0kg。
(5)464kg FeCO3中含有Fe元素4×103mol,设产品中FeO xmol ,Fe2O3ymol,则有:x + 2y=4×103,72x + 160y=316.8×103,解得x=2.2×103mol,y=1.8×103mol,故Fe2O3的质量=1.8×103mol×160g/mol=288.0kg。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com