
题目列表(包括答案和解析)
25.(14分)甲、乙、丙、丁为前三周期元素形成的微粒,它们的电子总数均为14。已知甲为原子;乙、丙、丁为双原子分子或离子。
(1)甲的原子结构示意图是 ;甲的氧化物晶体类型是 。
(2)乙是双原子分子,在高温时是一种还原剂。14g乙燃烧放出的热量是141.5kJ。
写出乙的燃烧热的热化学方程式 。
(3)丙为双原子二价阴离子,与钙离子组成的化合物能跟水反应产生一种可燃性气体,反应的化学方程式
是 。
该可燃性气体能与乙酸在一定条件下,按物质的量比1:1发生加成反应生成一种酯,化学方程式
是 。
(4)由丁分子组成的物质属于单质,组成丁的元素最高价氧化物对应的水化物X有下图所示转化
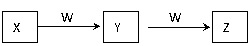
关系(反应条件和其他物质已略)
① 已知W为金属单质,W在周期表中的位置 。写出X的稀溶液与Z反应的离子方程式 。
② X的浓溶液与W在加热条件下反应生成气体Q,已知Q受热发生可逆的分解反应,1mol Q分解时,有1.204×1024个电子转移。 Q发生分解反应的化学方程式是
。
将Q装入密闭容器中,加热到T℃,达平衡时,测得密闭容器中的气体相对分子质量是Q的0.8倍。Q的分解率为 。
24.(12分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
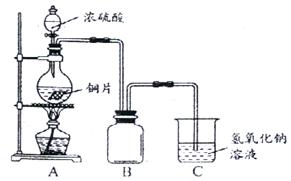
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请直接在原图上把导管补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
① 请写出铜跟浓硫酸反应的化学方程式:
② 为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是:
。
③ 下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是 (填写字母编号)
A.锌粒 B.石灰石 C.Na2CO3溶液 D.BaCl2溶液
(3)为定量测定余酸的物质的量浓度,甲、乙两学生进行了如下设计:
① 甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再计算余酸的物质的量浓度,他认为测定SO2的量的方法有多种,请问下列实验方案中不可行的是(填写字母编号) 。
A.将装置A产生的气体缓缓通过预先称量过盛有碱石灰的干燥管,结束反应后再次称量。
B.将装置A产生的气体缓缓通入足量的硫酸酸化的KMnO4中溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(已折算出标准状况)
② 乙学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000ml,取20 ml于锥形瓶中,滴入酚酞做指示剂,用标准氢氧化钠溶液进行滴定(已知:Cu(OH)2开始沉淀的PH约为5),通过测出消耗NaOH溶液的体积来求余酸的物质的量的浓度。
假定反应前后烧瓶中溶液的体积不变,你认为乙学生设计的实验方案能否求得余酸的物质的量浓度 (填“能”或“否”)。其理由是
23. (11分)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业。
(1)NaClO溶液pH>7,原因是(用离子反应方程式表示) 。
(2)根据NaClO的性质推测,在纸浆中加入NaClO溶液的目的是 。
(3)在1 mol/L 的KAl(SO4)2溶液中离子浓度由大到小的顺序是 。
(4)某小组同学用下图所示装置探究饱和NaClO和KAl(SO4)2溶液混合反应的实验。
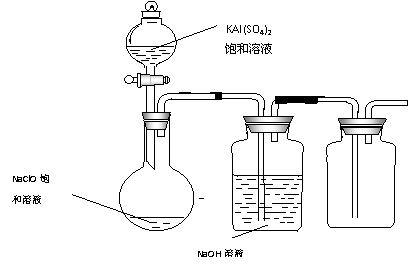
① 打开活塞向烧瓶中加入饱和KAl(SO4)2溶液,产生大量的白色胶状沉淀 。反应的离子方程式是 。
② 将烧瓶中的混合液在阳光照射下,不久烧瓶中有黄绿色气体产生。充分反应后集气瓶中气体能使带余烬的木条复燃。写出在光照下混合液中反应的化学方程式是
。
(5)若将V1 mL 0.1mol/L KAl(SO4)2溶液和V2mL 0.1mol/LBa(OH)2溶液混合。当产生沉淀的物质的量最多时,V1:V2 = 。
22.一定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c
2Z(g),若X、Y、Z的起始浓度分别为c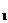 、c
、c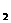 、c
、c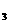 (均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
( )
(均不为零),到达平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是
( )
A.c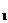 :c
:c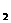 =2:3
B.平衡时,Y和Z的生成速率之比为2:3
=2:3
B.平衡时,Y和Z的生成速率之比为2:3
C.X、Y的转化率相等 D.c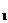 的取值范围为0.04<c
的取值范围为0.04<c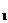 <0.14 mol/L
<0.14 mol/L
高三 年 级 化 学 试 题
将选择题的正确答案填入表中(每小题2分共44分)
第Ⅱ卷(非选择题 共56分)
21. 下列各溶液中,微粒的物质的量浓度关系正确的是
( )
A.1.0 mol·L-1Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+) + c(H2CO3)
B.1.0 mol·L-1 NH4Cl溶液:c(NH4+) = c(Cl-)
C.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液
c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)=c(NO3-)
20.广州将于2010年承办第16界亚运会。下列措施有利于节能减排、改善环境质量的有 ( )
①在大亚湾核电站已安全运行多年的基础上,广东将继续发展核电,以减少火力发电带来的二氧化硫和二氧化碳排放问题
②积极推行“限塑令”,加快研发利用二氧化碳合成的聚碳酸酯类可降解塑料
③加速建设地铁、轻轨等轨道交通,促进珠三角城市一体化发展,减少汽车尾气排放
④发展低碳经济、循环经济,推广可利用太阳能、风能的城市照明系统
⑤使用生物酶降解生活废水中的有机物,使用填埋法处理未经分类的生活垃圾
A.①②③④ B.①②⑤ C.①②④⑤ D.③④⑤
19.下列各组物质中,因反应条件、用量、浓度等不同而发生不同化学反应的是 ( )
①C与O2 ② P与Cl2 ③Fe与S ④Na与O2 ⑤CO2与NaOH溶液 ⑥Cu与硝酸
⑦AgNO3溶液与氨水 ⑧AlCl3溶液与氨水 ⑨NaAlO2与盐酸 ⑩Na2CO3与盐酸
A.除③⑨外 B.除③⑧外 C.除③⑦⑩外 D.除⑥⑦⑧外
18.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4 氧化性更强,无二次污染的绿色处理剂。工业上是先制得高铁酸钠,然后在低温下,在高铁酸钠溶液中湿法制备的主要离子方程式为: 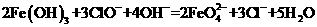
干法制备的主 要 反 应 为: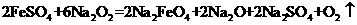
下列有关说法不正确的是 ( )
A.高铁酸钾中铁显+6价
B.湿法中每生成1molNa2FeO4 转移3mol电子
C.干法中每生成1molNa2FeO4 转移4mol电子
D.K2FeO4 处理水时,不仅能消毒杀菌,还能除去水体中的H2S等,生成的Fe(OH)3还能吸附水中的悬浮杂质
17.为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是 ( )
|
选项 |
被提纯的物质(杂质) |
除杂试剂 |
分离方法 |
|
A |
H2S(H2O) |
浓硫酸 |
洗气 |
|
B |
H2O(Br2) |
CCl4 |
分液 |
|
C |
KCl固体(I2) |
KOH溶液 |
加热 |
|
D |
苯(苯酚) |
浓溴水 |
过滤 |
16.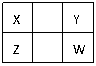 已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如右图所示,下列说法正确的是
已知X、Y、Z、W四种短周期元素(均非稀有气体元素)在周期表中的相对位置如右图所示,下列说法正确的是
( )
A.Z元素的原子半径可能比Y元素的小
B.Z元素的最高化合价可能比Y元素的高
C.W形成的单质的熔点高于Y
D.Z的最高价氧化物的水化物的酸性一定比W的强
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com