
题目列表(包括答案和解析)
3.在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序是
A.p(Ne)>p(H2)>p(O2) B.p(O2)>p(Ne)>p(H2)
C.p(H2)>p(O2)>p(Ne) D.p(H2)>p(Ne)>p(O2)
2.下列反应一定属于氧化还原反应的是 ( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
1.设NA为阿伏加德罗常数,下列说法不正确的是 ( )
A.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
B.18g水中含有的电子数为10NA
C.46gNO2和46gN2O4含有的原子数均为3NA
D.在1L 2mol/L的硝酸镁溶液中含有的硝酸根离子数为4NA
25、(5分)将一块金属钠投入到100ml MgCl2和AlCl3的混合溶液中,发现沉淀先多后少。反应完毕后收集到13.44L气体(标准状态),同时得到21.4g白色沉淀,将此沉淀溶于过量的NaOH溶液中,充分反应后沉淀质量减轻了15.6g。求原溶液中Mg2+、Al3+、Cl-的物质的量浓度。
24、某无色溶液X,由Na+ 、Ag+ 、Ba2+ 、Al3+ 、[Al(OH)4]-- 、 MnO4-、CO32-- 、SO42-中的若干种离子组合,取溶液进行如下连续试验:(填化学用语)
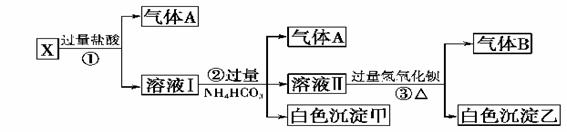 1)气体A的成分是:_________________,气体B的成分是_____________
1)气体A的成分是:_________________,气体B的成分是_____________
2)X溶液中一定存在的离子是:____________________________
3)写出步骤①发生反应的所有离子反应方程式:L_________________________
4)写出步骤②形成白色沉淀甲的离子方程式:______________________
5)写出白色沉淀乙的可能组成:____________________________
23、炼金废水中含有络离子[Au(CN)2]+,其电离出的CN-有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为___________________________
3)处理这种废水是在碱性条件下,NaClO将CN-氧化为碳酸根和氮气,其离子方程式为:____________________________________
4)在酸性条件下,ClO-也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_______________________________
22、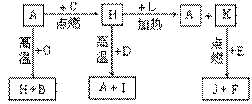 (14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:请回答下列问题:
(14)A、B、C、D、E、F是常见单质,其中A是用量最大,应用最广泛的金属;元素D是地壳中含量最多的金属元素;D元素和E元素在周期表中相邻。G、H、I、J、K、L是常见化合物,其中G在常温下是无色液体,H是黑色固体。以上物质相互间的转化关系如图所示:请回答下列问题:
(1)元素A在元素周期表中的位置为 周期 族。
(2)写出K的电子式 。
(3)写出H和D反应的化学方程式 。
(4)D能与氢氧化钠溶液反应,请写出该反应的离子方程式 。
(5)写出A与G反应的化学方程式 。
(6)K与E反应时产生的现象有 ;该反应的化学方程式为 _____________________________________。
(7)已知F的燃烧热为akJ/mol,L的燃烧热为bkJ/mol,试写出F生成L的热化学方程式____________________________________________
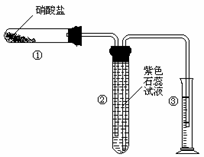
21.(11) 某校化学兴趣小组的同学对硝酸盐的受热分解进行探究。他们设计了如下装置分别加热了Ca(NO3)2、Cu(NO3)2、AgNO3三种固体。(加热及夹持装置未画出)
(1)甲同学加热的是Ca(NO3)2。加热过程发现:装置②中产生 气泡,部分石蕊试液被压至装置③中;用带火星的木条检验②中的气体,木条复燃;分析装置①中剩余的固体得知,剩余固体中含有N元素,且显+3价。请写出Ca(NO3)2受热分解后生成产物的化学式: 、 。
(2)乙同学加热的是Cu(NO3)2。加热过程发现:装置②中也有气泡产生,但在上升的过程中消失。石蕊试液逐渐变为红色,液体几乎不被压至装置③中。装置①中的固体逐渐变为黑色。请写出Cu(NO3)2受热分解的化学方程式: ;
(3)丙同学加热的是AgNO3。加热过程发现:装置②中也有气泡产生,但在上升的过程中气泡部分消失,剩余的气体也能使带火星的木条复燃。石蕊试液也逐渐变为红色,有少量液体被压至装置③中。装置①中的固体逐渐变为黑色。丙同学据此写出了AgNO3受热分解可能的两种化学方程式:
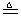 (Ⅰ)4AgNO3
2Ag2O+4NO2↑+O2↑,
(Ⅰ)4AgNO3
2Ag2O+4NO2↑+O2↑,
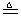 (Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。
(Ⅱ)2AgNO3 2Ag+2NO2↑+O2↑。
Ⅰ、Ⅱ中正确的是 ,并说明理由: 。
请你设计一个简单的实验证明你的结论是正确的: 。
(4)由上述3个实验的结果,请你推测硝酸盐受热分解的规律: 。
(5)标况下如丙同学操作,称量ag硝酸银,受热完全分解后,读取量筒体积为bml,求硝酸银的分解率:____________(化简成整数比例关系,可不用化成小数)
20、分子式为C4H8O3的有机物,一定条件下具有如下性质:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在浓硫酸存在下,能脱水生成一种能使溴水褪色的物质,该物质只存在一种结构形式;③在浓硫酸存在下,能生成一种分子式为C4H6O2的五元环状化合物。则C4H8O3的结构简式为
 A.HOCH3COOCH2CH3 B.CH3CH(OH)CH2COOH
A.HOCH3COOCH2CH3 B.CH3CH(OH)CH2COOH
C.HOCH2CH2CH2COOH D.CH3CH2CH(OH)COOH
19、将pH=1的稀硫酸慢慢加入-定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时溶液的体积为100 mL(混合时溶液体积的变化忽略不计),且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度约为
A.0.011 mol/L B.0.22 mol/L C.0.022 mol/L D.0.11 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com