
题目列表(包括答案和解析)
7.在指定环境下,下列各组离子可以大量共存的是
A.在无色透明溶液中:Al3+、Na+、HCO3-、Cl-
B.在能使甲基橙呈红色的溶液中:Mg2+、NH4+、Fe2+、I-
C.加入铝粉放出氢气的溶液: K+、Ca2+、NO3-、SO42-
D.在水电离产生的H+的浓度为1×10-13mol・L-1的溶液:Cu2+、Na+、NO2-、SO42-
6.根据中学化学教材所附元素周期表判断,下列叙述不正确的是
A.若周期表中第七周期完全排满共有32种元素
B.周期表中共有18个列,其中形成化合物种类最多的在第14列
C.除过渡元素外周期表中最外层电子数相同的元素都位于同一族中
D.L层电子为奇数的所有元素所在族的序数与该元素原子的L层电子数相等
5.下列离子方程式中正确的是
A.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O
C.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
D.少量CO2加入到苯酚钠溶液中
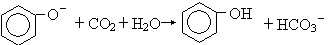
4.设阿伏加德罗常数的值为NA。下列叙述正确的是
A.常温常压下,NO2和N2O4的混合物46g中约含有2NA个氧原子
B.在Cu-Zn原电池中,正极产生1.12LH2时,负极产生了0.05 NA 个 Zn2+
C.1.0L0.1 mol·L-1的NH4Cl溶液中NH4+的个数为0.1NA
D.常温常压下,1molCl2与足量的Fe反应转移3NA个电子
3.绿色农药--信息素的推广使用,对环保有重要意义。有一种信息素的结构简式为CH3(CH2)5CH=CH(CH2)9CHO。下列关于检验该信息素中官能团的试剂和顺序正确的
A.先加入酸性高锰酸钾溶液;后加银氨溶液,水浴加热
B.先加入溴水;后加酸性高锰酸钾溶液
C.先加入新制氢氧化铜悬浊液,加热;再加入溴水
D.先加入银氨溶液;再另取该物质加入溴水
2. 2010年诺贝尔物理学奖授予曼彻斯特大学的两位科学家,以表彰他们在石墨烯材料方面的卓越研究。石墨烯是由石墨剥离而成的单层片状结构的新材料(结构如图),性质稳定、导电性好,有望代替硅引发电子工业革命。下列说法中正确的是
2010年诺贝尔物理学奖授予曼彻斯特大学的两位科学家,以表彰他们在石墨烯材料方面的卓越研究。石墨烯是由石墨剥离而成的单层片状结构的新材料(结构如图),性质稳定、导电性好,有望代替硅引发电子工业革命。下列说法中正确的是
A.石墨烯之所以稳定主要是因为碳原子间都以共价键相结合
B.石墨烯的发现又为碳的同位素家族增添了一种新的核素
C.由于石墨烯为原子晶体所以石墨烯应具有很高的熔点
D.石墨烯属于烯烃类的物质,因此在一定条件下可与氢气发生加成反应。
1.下列说法正确的是
A.工业生产玻璃、水泥、陶瓷都要使用石灰石做原料
B.开发氢能、太阳能、风能、生物质能等新型能源是践行低碳生活的有效途径
C.“把世博会期间产生的垃圾焚烧或深埋处理”方案符合上海世博会实现“环保世博、生态世博”的目标
D.“光化学烟雾”、“臭氧层空洞”、“温室效应”、“硝酸型酸雨”的形成都与氮氧化合物有关
20.(13分)锂离子电池的广泛应用使回收利用锂资源成为重要课题。某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4和碳粉涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
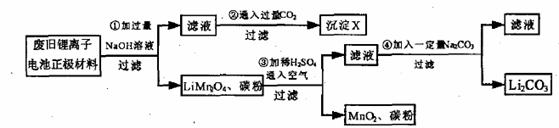
(1)第①步反应可能产生气体的化学式是 ;第②步反应得到的沉淀X的化学式为 。
(2)第③步反应有锂离子(Li+)生成,其反应的离子方程式是 。
(3)四步实验都包含过滤,实验室中过滤实验要使用的玻璃仪器包括 。
(4)若废旧锂离子电池正极材料含LiMn2O4的质量为18.1 g,第③步反应中加入20.0 mL 3.0 mol·L-1的H2SO4溶液,假定正极材料中的锂经反应③和④完全转化为Li2CO3,则至少有 g Na2CO3参加了反应。
19.(12分)在一体积为10 L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g) △H<0。CO和H2O浓度变化如下图:
CO2(g)+H2(g) △H<0。CO和H2O浓度变化如下图:
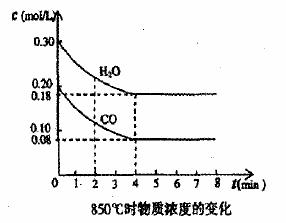
(1)0一4min的平均反应速率v(CO)= mol/(L·min)。
(2)850℃时,平衡常数K= 。
(3)850℃时,若向该容器中充入1.0 mol CO、3.0 mol H2O,则CO的平衡转化率为 。
(4)能判断该反应达到化学平衡状态的依据是 (填选项序号)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
e.容器中气体密度不变
f.1 mol H-H键断裂的同时断裂2 mol H-O键
18.(12分)金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和金属钙Ca,并含有3。5%(质量分数)CaO。
(1)Ca元素原子结构示意图 ,Ca(OH)2碱性比Mg(OH)2 (填“强”或“弱”)。
(2)Ca与非金属最强的元素A形戒化合物D,D的电子式为 。
|
(3)配平用钙线脱氧脱鳞的化学方程式:P+FeO+CaO Ca3(PO4)2+Fe
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n。则金属M为 (填元素符号);检测Mn+最常用的试剂是 (填化学式)。
(5)取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3 g.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com