
题目列表(包括答案和解析)
9.(改编)(14分) 联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)工业上有一种方法是用CO2来生产燃料甲醇。298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如下所示ww.k@s@5@ 高#考#资#源#网,据图回答问题:
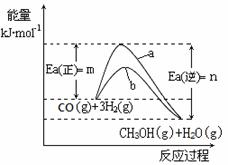
①写出合成甲醇反应的热化学方程式_____________________________________;
②在图中曲线_____(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理是____________________________________________________;
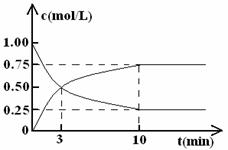 ③在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
③在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= ;
该反应的平衡常数k= 。ww.k@s@5@ 高#考#资#源#网
(2)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
 2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表。分析表中数据回答下列问题:
 |
500 |
600 |
700 |
800 |
|
1.5 |
45 |
33 |
20 |
12 |
|
2.0 |
60 |
43 |
28 |
15 |
|
3.0 |
83 |
62 |
37 |
22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇 (填“有利”或“不利”)。
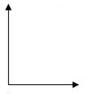 ③在右图的坐标系中作图说明压强变化对反应①的化学平衡的
③在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
8.(改编)(14分)A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。期中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。
回答下列问题:
(1)C与D形成的化合物的化学式是 ,它的性质决定了它在物质的分类中应属于 ;该化合物的水化物的电离方程式是 。
(2)将X气体通入A与F形成的化合物的水溶液中,使之恰好完全反应。此时溶液呈 性,(填“酸”、“碱”、“中”);溶液中离子浓度由大到小的顺序为______________ _。
(3)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的化学方程式是 。
(4)写出X分子的等电子体(原子数和电子数均相等的粒子) (用电子式表示),
并写出该等电子体与X溶液反应的离子方程式: 。
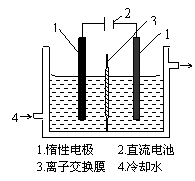
7.(2010年四川卷改编) 碘被称为“智力元素”,科学合理地补碘可防止碘缺乏症。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。以碘为原料,通过电解可以制备碘酸钾。电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2 + 6KOH = 5KI + KIO3 + 3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却(实验装置如右图所示)。以下有关该实验的说法错误的是:
A. 碘是紫黑色固体物质,实验室常用升华法来分离提纯含有少量杂质的固体碘
B. 电解时,阳极上发生反应的电极反应式为I- + 6OH- -6e- = IO3- + 3H2O
C. 通过离子交换膜的K+离子的运动方向是从右向左
D. 当有3mol电子发生转移时,其中被还原生成的KIO3的物质的量为0.5mol
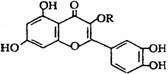
6.(改编)天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂。关于维生素P的叙述正确的是ww.k@s@5@ 高#考#资#源#网
A.若R为甲基则该物质的分子式可以表示为C16H10O7
 B.该物质中最多有7个碳原子共平面
B.该物质中最多有7个碳原子共平面
C.lmol该化合物最多可与5molBr2完全反应
D.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
5.(改编)下图是某些实验的部分装置,其中所注明的实验能达到实验目的的是
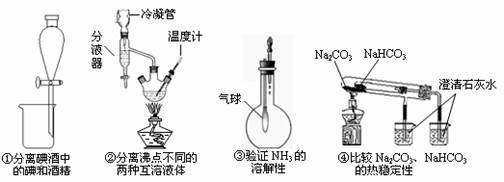
A.①② B.③④ C.①③ D.②④
4.(原创)下列叙述中,正确的是
A. 0.1mol·L-1CH3COONa溶液中:c(Na+)=c(CH3COO-)+c(OH-)
B.一定量Na2S溶液中各离子浓度存在以下关系:2 c(Na+)= c(HS-)+ c(H2S)+ c(S 2- )
C.中和PH与体积均相等的盐酸和醋酸溶液,消耗NaOH的物质的量相等
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则
c(NH4HSO4) < c(NH4NO3) < c(NH4HCO3)
3.(原创)设NA代表阿伏加德罗常数的数值,下列说法中正确的是
A.常温常压下,9g甲烷(14CH4)所含的中子数为5NA
B.64g的铜发生氧化还原反应,一定失去2NA个电子
C.常温常压下,48g O2与O3的混合物中O原子个数为3NA
D.标准状况时,11.2LNO和11.2LO2混合后的气体中含有的分子总数为0.75NA
2.(原创)下列关于物质结构与性质的叙述中,正确的是
A.因甲基对苯环的影响,使甲苯具有较强的活性,故能在浓硫酸的作用下与浓硝酸发生加成反应生成TNTww.k@s@5@ 高#考#资#源#网
B.氯化氢溶于水能导电是因为氯化氢分子中存在自由移动的H+和Cl-
C.有机物的同系物之间性质一定相似
D.因为淀粉分子与胶体颗粒大小相近,故淀粉溶液具有丁达尔现象
1.(原创)下列说法中正确的是
A. 合成纤维和光导纤维都是新型的无机非金属材料
B. 利用风能发电、采取节能技术、使用太阳能热水器和无氟制冷剂均可直接降低碳排放
C. 红外光谱仪、核磁共振仪、元素分析仪都可用于有机化合物结构的分析
D. 人们借助扫描隧道显微镜,应用STM技术可以“看”到越来越细微的结构,并实现对原子或分子的操控
11.(根据2011年富阳中学高考预测卷第17题改编)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用下图所示装置先进行了有关实验:
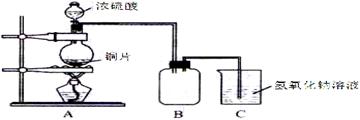
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整。
(2)实验中他们取6.4g 铜片和12mL 18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①写出铜跟浓硫酸反应的化学方程式:____________________________________;
②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是____________________;
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:________(填写编号)。
A.铁粉 B.氯化钡溶液 C.银粉 D.碳酸氢钠溶液
(3)为定量测定余酸的物质的量浓度,甲学生进行了如下设计学生设计的方案是:在反应后的溶液中加蒸馏水稀释至1000mL,取20mL与锥形瓶中,滴入2~3滴甲基橙指示剂,用标准氢氧化钠溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),通过测出消耗氢氧化钠溶液的体积来求余酸的物质的量浓度。假定反应前后烧瓶中溶液的体积不变,你认为他设计的实验方案能否求得余酸的物质的量浓度_______(填“能”或“不能”),其理由是_________________________________________________。ww.k@s@5@ 高#考#资#源#网
(4)现已确认,SO2和NOx的排放是造成酸沉降的两大罪魁祸首。汽车排放的尾气中含有未燃烧充分的CH、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO  N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
N2 + 2CO2 将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
|
时间/h |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
4.5×10-4 |
2.5×10-4 |
1.5×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/mol·L-1 |
3.6×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
在上述条件下反应能够自发进行,则反应的 ______
0(“>”、“<”、“=”)。前2h内的平均反应速率v(N2)=
_____________,在该温度下,反应的平衡常数K= ____________ 。据此你认为将该反应从理论转化为现实的最重要的研究方向是___________________
______
0(“>”、“<”、“=”)。前2h内的平均反应速率v(N2)=
_____________,在该温度下,反应的平衡常数K= ____________ 。据此你认为将该反应从理论转化为现实的最重要的研究方向是___________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com