
题目列表(包括答案和解析)


| ||
| ||


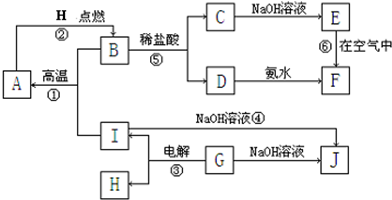
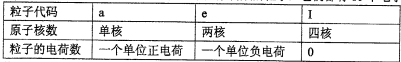
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①—⑤ 都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
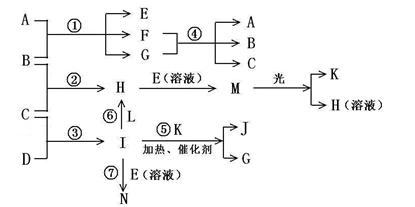
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M____________________________________________________,
F + G →A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是________________________。
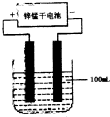
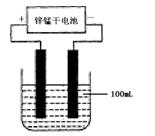
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
物质A由a、e 构成, B、C、D、K都是单质,各有关物质之间的相互反应转化关系如下图所示,反应①—⑤ 都是用于工业生产的反应,⑥、⑦反应中个别产物在图中略去。
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H + E(溶液)→M____________________________________________________,
F + G→A + B + C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是________________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)
已知a、e、I为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
 |
请填写下列空白:
(1)写出下列物质的化学式:B__________,J__________。
(2)写出下列反应的离子反应方程式:
H +E(溶液)→M_____________________________,
F +G →A + B +C________________________________________;
(3)E(溶液)能与I以1∶2的物质的量之比反应生成N、F和G,N中各原子均已达到惰性气体的稳定结构,写出N的结构式__________;
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素CO(NH2) 2 和物质H,写出L的电子式__________;
(5)反应③用于工业生产它应在_______________进行(填设备名称);反应④用于工业生产时为了防止B和C混合反应产生危险,所使用的一种特殊材料的名称为__________,在该工业生产中它具有的特殊的性质是___________________。
(6)常温下,实验室模拟工业反应④的过程如下图所示,标况下,当电极上产生112mL(已折算为标准状况下的体积)B气体时,烧杯中溶液的pH=__________。(假设气体完全逸出,溶液体积不变)

一 二、选择题
题号
1
2
3
4
5
6
7
8
答案
B
A
D
B
B
A
D
D
题号
9
10
11
12
13
14
答案
D
BD
CD
C
AD
AC
15.(1)防止暴沸 冷凝回流
(2)3.2
(3)温度过高发生副反应。
(4)除去产物中的丁醇。(每空2分)
16.(1)SO2
(1分) 
 (1分) (2)第四周期第Ⅷ族(2分)
(1分) (2)第四周期第Ⅷ族(2分)
(3)2Al+Fe2O3 Al2O3+2Fe (2分) 0.1 mol (1分)
Al2O3+2Fe (2分) 0.1 mol (1分)
(4) ③(1分)
(5) 3Fe2++NO3- +4H+ = 3Fe3++NO↑+2H2O(2分)
(6) Fe2O3+3KNO3+4KOH  2K2FeO4+3KNO2+2H2O(2分)
2K2FeO4+3KNO2+2H2O(2分)
17.(共8分)
(1)0.075mol/L?min(1分)
(2)放热, CO(g)+2H2(g) → CH3OH(g) +91KJ, 不能(各1分,共3分)
(3)K = ,减小;(各1分,共2分) (4)c(2分)
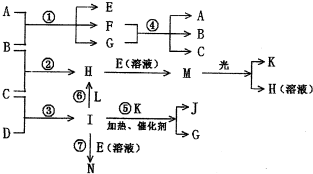
18.
(1)反应速率突然减小(或铁片表面生成的气泡突然减少)(2分)
(2)过滤(1分)
(3)b、d(2分),Fe和Cu(1分)
(4)抑制Fe2+、NH4+水解(2分)
(5)避免加热过程中晶体受热分解(或被氧化)(2分)
19.(每空2分)
(1) 氧化还原反应 (2)
氧化还原反应 (2)
(3)C10H12O4
(4)
20.(每空2分,共10分)
(1)2.8×105 ;18
(2)86.96%
(3) ;138
;138
21.A(1)●:AlF6- ○:Na+ AlF6- 电解炼铝的助熔剂(各1分)
(2).H2O2分子间存在氢键(1分),与水分子可形成氢键(1分)。
(3)3d104s1(1分) Cr(1分) 共价键、配位键(2分)
降低Cu(NH3)4SO4?H2O的溶解度(2分)
B.(1) Fe + 2H+ → Fe2+ + H2↑;CuO + 2H+ → Cu2+ + H2O (各2分)
(2) ① (1分)
(3) ③ (1分)
(4) ①③ (2分)
(5) ②④① (2分)
(6)二; (1+3分)
(1+3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com