
题目列表(包括答案和解析)
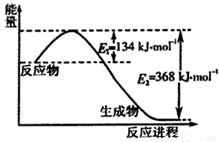
 O2(g)=CO2(g)的△H=______kJ?mol-1
O2(g)=CO2(g)的△H=______kJ?mol-1 O2(g)△H=a kJ?mol-1
O2(g)△H=a kJ?mol-1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:
2NH3(g)△H=-92.4kJ?mol-1,实验测得反应起始时、达到平衡时的有关数据如下表所示:| 容器 编号 | 起始时各物质的物质的量/mol | 反应达平衡时的焓变/kJ?mol-1 | ||
| N2 | H2 | NH3 | ||
| A | 1 | 3 | △H1=-23.1 | |
| B | 0.9 | 2.7 | 0.2 | △H2 |
| A、2s内用物质A表示的平均反应速率为0.3mol?L-1?s-1 | B、2s内用物质B表示的平均反应速率为0.6mol?L-1?s-1 | C、2s时物质B的转化率为70% | D、x=2 |
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
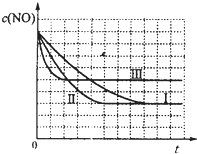
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| ① | 350 | 1.20×10-2 | 5.80×10-2 | 124 |
| ② | 280 | 1.20×10-2 | 5.80×10-2 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| NO | N2 | CO | |
| 起始浓度mol.L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.04 | 0.03 | 0.03 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol?L-1) | 10.0 | 4.05 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)(×10-3mol?L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
| A、该反应转化较快,具有存实际意义 |
| B、催化转化器在冬季时对废气转化效率比夏季更高 |
| C、2s末的平均反应速率v(NO)=3.75×10-4mol?L-1?S1 |
| D、在该温度下,反应的平衡常数K=5000 |
命题人:李孝平 审题人:李白仲
一、二选择题:(1―10题每题2分,11-18每题3分,共44分)
题 号
1
2
3
4
5
6
7
8
9
10
答 案
B
D
A
B
D
C
C
B
B
C
题 号
11
12
13
14
15
16
17
18
答 案
D
B
B
C
C
D
A
A
三、填空题:(本题共5小题,共46分)
19、①、③、⑧; ②、④; ⑤; ⑥、⑦;(每空1分)
20、(1) 略 3分 ;(2)略 4分
(3)c3>c1>c2;CH3COOH; D。(各2分)
21、(1)、4;(2分) (2)、大于(1分);因为升温水的电离平衡右移,离子浓度增大,Kw增大;(2分)
22、(1)H-O-O-H(2分) (2)N2H4(l)+H2O2(l) == N2(g) +2H2O(l) △H=-644.25 KJ/mol(3分)(3)产物不会造成环境污染。(1分)
23、(10分)(1)1 (2分) (2)否、(2分) 大于(1分) 因为
试卷.files/image027.gif)
试卷.files/image029.jpg)
试卷.files/image031.jpg)
= = <K平衡向右移动(3分)
(3)增大 减小(各1分)
24、(1)加快 (2)D (3)40% 试卷.files/image033.gif) L (各2分)
L (各2分)
25、(10分)⑴、反应产生气泡快慢或反应完成的先后或试管壁的冷热程度 ;
控制阴离子相同,排除阴离子的干扰 ; 将FeCl3改为Fe2(SO4)3
⑵、关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 一定时间内收集到的气体体积或收集一定体积的气体所需要的时间 ( 合理答案同样给分) 各2分
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com