
题目列表(包括答案和解析)
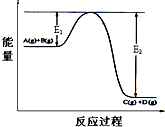 反应A(g)+B(g)?2C(g)+D(g);△H=Q kJ/mol.过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?2C(g)+D(g);△H=Q kJ/mol.过程中的能量变化如图所示,回答下列问题.| c2(C)c(D) |
| c(A)c(B) |
| c2(C)c(D) |
| c(A)c(B) |
在容积可变的密闭容器中存在如下反应:2A(g)+2B(g) C(g) +3D(g);△H<0。该可逆反应的反应速率—时间、转化率—时间关系图如下:
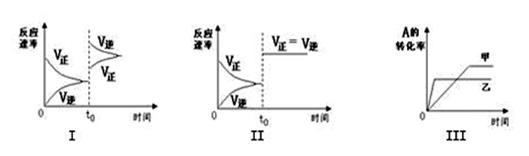
下列分析中不正确的是
A.图I可体现t0时升高温度对反应速率的影响
B.图II可体现t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图III可体现催化剂对化学平衡的影响,且甲使用了催化剂
D.图III可体现温度对化学平衡的影响,且乙的温度较高
在容积可变的密闭容器中,2 molN2和8 molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于
A.5% B.10% C.15% D.20%
(1)正反应速率______________;
(2)逆反应速率______________;
(3)平衡______________;
(4)容器内颜色______________;
(5)H2的质量分数______________;
(6)混合气体的平均相对分子质量______________;
(7)H2的浓度______________;
(8)HI的分解率______________;
(9)混合气体的密度______________;
(10)混合气体的质量______________。(用“变大”“变小”“不变”“加深”“变浅”填写)
I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,X、Y在周期表中相对位置如下图。
X |
|
|
|
| Y |
(1)X在周期表中的位置是________。
(2)Z单质与石灰乳反应的化学方程式为________。
(3)Y的气态氢化物通入FeCl3溶液中,有Y单质析出,该反应的离子方程式为___。
(4)W-Y高能电池是一种新型电池,它以熔融的W、Y单质为两极,两极之间通过固体电解质传递W+离子。电池反应为:16W(l)+nY8(l)  8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
II.在容积可变的密闭容器中充入A、B、C三种气体,发生反应:xA+yB zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:

(5)根据①②数据分析得出:x+y ___z(填“>”、“<”或“=”)。
(6)该温度下,当压强为1×106 Pa时,此反应的平衡常数表达式为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com