(2008?海南)A、B、C、D、E均为有机化合物,它们之间的关系如图所示(提示:RCH=CHR′在酸性高锰酸钾溶液中反应生成RCOOH和R′COOH,其中R和R′为烷基).

(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为
C5H10O
C5H10O
.
(2)已知B与NaHCO
3溶液完全反应,其物质的量之比为1:2,则在浓硫酸的催化下,B与足量的C
2H
5OH发生反应的化学方程式是
HOOC-CH
2-COOH+2C
2H
5OH
C
2H
5OOC-CH
2-COOC
2H
5+2H
2O
HOOC-CH
2-COOH+2C
2H
5OH
C
2H
5OOC-CH
2-COOC
2H
5+2H
2O
,反应类型为
酯化反应
酯化反应
.
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是
HO-CH2-CH2-CH=CH-CH3
HO-CH2-CH2-CH=CH-CH3
.
(4)D的同分异构体中,能与NaHCO
3溶液反应放出CO
2的有
2
2
.种,其相应的结构简式是
CH3CH2CH2COOH、CH3CH(CH3)COOH
CH3CH2CH2COOH、CH3CH(CH3)COOH
.

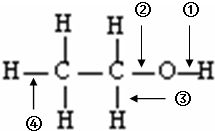 依据如图所示的乙醇分子结构分析,下列关于乙醇在各种反应中化学键断裂情况的说法正确的是( )
依据如图所示的乙醇分子结构分析,下列关于乙醇在各种反应中化学键断裂情况的说法正确的是( )