( I)在2L密闭容器中,800℃时反应2NO(g)+O
2(g)?2NO
2(g)体系中,n(NO)随时间的交化如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=______,已知:K(300℃)>K(350℃),该反应是______反应(填“放热”或“吸热”);
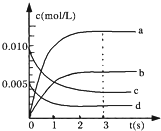
(2)如图中表示NO
2的变化的曲线是______,用O
2的浓度变化表示从0~2s内该反应的平均速率v=______;
(3)能说明该反应已经达到平衡状态的是______
a. v(NO
2)=2v(O
2);b.容器内压强保持不变;c.v逆(NO)=2v正(O
2);d.容器内物质的密度保持不变.
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是______
a.及时分离出NO
2气体;b.适当升高温度;c.增大O
2的浓度;d.选择高效的催化剂.
( II)用石墨做电极电①稀H
2SO
4 ②K
2SO
4溶液 ③CuCl
2溶液 ④CuSO
4 溶液 ⑤KOH溶液.
(1)阴阳极都有气体产生,且体积比(相同条件下)为2:1的是______(填序号,下同),其阳极的电极反应式都是______,总反应的化学方程式是______.
(2)阴极.阳极都有气体产生,其中溶液的pH变小的是______,pH变大的是______.
(3)一个电极析出金属,一个电极析出气体,且溶液pH明显减小的是______,其总反应的化学方程式是______.

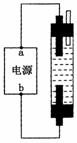 某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱
某学生想制作一种家用环保型消毒液发生器,用石墨做电极电解饱 ( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的交化如下表:
( I)在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的交化如下表: