
题目列表(包括答案和解析)
| A、生成40.0LN2(标准状况) | B、有0.250mol KNO3被氧化 | C、转移电子的物质的量为1.25mol | D、被氧化的N原子的物质的量为3.75mol |
汽车剧烈碰撞时,安全气囊中发生反应: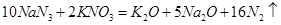 。则下列判断错误的是.
。则下列判断错误的是.
A.该反应能在瞬间完成,并产生大量气体
B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol
C.该反应中的氧化剂为KNO3
D.被氧化和被还原的N原子的物质的量之比为15:1
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 = K2O+5Na2O+16N2↑,对于该反应,下列判断正确的是
A. NaN3中氮元素的化合价为—3
B.氧化剂和还原剂是同一物质
C.反应过程中若转移1mol电子,则产生2.24L气体(标准状况)
D.被氧化的氮原子与生成的氮气分子个数之比为15:8
汽车安全气囊是汽车安全性辅助配置之一。汽车剧烈碰撞时,安全气囊中发生反应:10NaN3 + 2KNO3 == K2O + 5Na2O + 16N2↑,则下列判断不正确的是
A.NaN3是还原剂
B.N2既是氧化产物又是还原产物
C.氧化产物与还原产物物质的量之比为1:15
D.标准状况下,当有10mol电子转移时生成358.4L N2
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3→K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成42.0LN2(标准状况)
B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol
D.被氧化的N原子的物质的量为3.75mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com