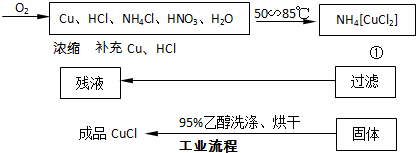
(2013?湖州二模)硫酸四氨合铜([Cu(NH
3)
4]SO
4?H
2O)为深蓝色晶体,在工业上主要用于印染、纤维、杀虫剂及制备某些含铜的化合物.一水合硫酸四氨合铜加热到650℃可分解为铜、氮气、氨气、二氧化硫和水.请回答下列问题:
(1)写出氨气的电子式
.
(2)配平硫酸四氨合铜晶体受热分解的化学方程式:
3
3
[Cu(NH
3)
4]SO
4?H
2O═
3
3
Cu+
2
2
N
2+
8
8
NH
3+
3
3
SO
2+
9
9
H
2O
(3)向铜氨溶液中加少量稀盐酸会出现蓝色沉淀,反应的离子方程式为
[Cu(NH3)4]2++2H++2H2O=Cu(OH)2↓+4NH4+
[Cu(NH3)4]2++2H++2H2O=Cu(OH)2↓+4NH4+
;
(4)在工业上常用较高浓度的铜氨溶液来制取铜氨纤维,请写出配制该较高浓度铜氨溶液的方法
向试管中加入5%的硫酸铜溶液,再加入10%的氢氧化钠溶液至沉淀完全,静置片刻后,倒去上层清液,用浓氨水溶解得到的氢氧化铜沉淀,以获得浓度较高的铜氨溶液
向试管中加入5%的硫酸铜溶液,再加入10%的氢氧化钠溶液至沉淀完全,静置片刻后,倒去上层清液,用浓氨水溶解得到的氢氧化铜沉淀,以获得浓度较高的铜氨溶液
.
(5)在一定条件下,液氨可与某金属反应生成固体A,取3.90g固体A与5.35g氯化铵固体恰好完全反应,生成NaCl和4.48L氨气(标准状况),则A的化学式为
NaNH2
NaNH2
.物质A保存不当有一定的危险,遇到这种情况,可用苯或甲苯将其覆盖,然后缓慢加入用甲苯稀释过的无水乙醇将A销毁,试写出该反应的化学方程式
NaNH2+C2H5OH=C2H5ONa+NH3↑
NaNH2+C2H5OH=C2H5ONa+NH3↑
;并解释其化学反应能够发生的原因是
乙醇羟基上的氢较活泼,可以跟氨基钠反应
乙醇羟基上的氢较活泼,可以跟氨基钠反应
.

 (2010?南京二模)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.
(2010?南京二模)纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物.