
题目列表(包括答案和解析)
(12分)测定硫酸铝晶体样品中Al2(SO4)3·18H2O(M=666g/mol)质量分数的实验步骤为(物质EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应):
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,测定得知:,当加入c2 mol·L-1Pb(NO3)2溶液V2mL 恰好与过量的EDTA溶液反应。
⑴步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
、 。
⑵请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。
⑶若将步骤1所得的溶液改为滴加4mol/L NaOH溶液(杂质不参与反应),当滴加到10mL时,溶液又恰好变澄清,求步骤1溶液中硫酸铝的物质的量浓度(用具体数值表示)。
(12分)测定硫酸铝晶体样品中Al2(SO4)3·18H2O(M=666g/mol)质量分数的实验步骤为(物质EDTA分别能与Al3+或Pb2+以物质的量之比1︰1进行反应):
步骤1:准确称取硫酸铝晶体样品m g,溶于25 mL水中。
步骤2:加入c1 mo1·L-1EDTA溶液V1mL(过量),煮沸、冷却,稀释至100 mL。
步骤3:取25. 00mL上述稀释液,测定得知:,当加入c2 mol·L-1Pb(NO3)2溶液V2mL 恰好与过量的EDTA溶液反应。
⑴步骤2中“稀释至100 mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
、 。
⑵请根据上述数据计算该样品中Al2(SO4)3·18H2O的质量分数。(用含字母的代数式表示)。
⑶若将步骤1所得的溶液改为滴加4mol/L NaOH溶液(杂质不参与反应),当滴加到10mL时,溶液又恰好变澄清,求步骤1溶液中硫酸铝的物质的量浓度(用具体数值表示)。

| ||
| ||
| ||
| ||

| c mol?L-1×b×10-3L×250g?mol-1×5 |
| ag |
| c mol?L-1×b×10-3L×250g?mol-1×5 |
| ag |
(14分)以明矾石[主要成分为K2SO4·Al2(SO4)3·2A12O3·6H2O]为原料生产硫酸铝晶体[Al2(SO4)3·18H2O]和明矾[KAl(SO4)2·12H2O]的实验流程如下: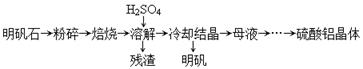
两种不同形态的氧化铝的部分性质如下表:
| 物质 | α-Al2O3 | γ-A12O3 |
| 性质 | 不溶于水和酸 | 不溶于水,溶于强酸或强碱,加热至1200℃可转化为α- Al2O3 |
| 温度/℃ 溶解度/g | 0 | 20 | 40 | 60 | 80 | 100 |
| Al2(SO4)3 | 31.2 | 36.4 | 46.1 | 59.2 | 73.0 | 89.0 |
| 明矾 | 3.0 | 5.9 | 11.7 | 25 | 71 | 154 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com