(2009?深圳二模)I、(1)下列实验操作或实验问题处理方法中,正确的是
ABE
ABE
(填序号)
A.不慎将酸溅到眼中,立即用水冲洗,边洗边眨眼睛
B.酒精灯洒漏少量酒精着火,用湿布盖灭
C.实验剩余的NaOH放回原试剂瓶
D.在容量瓶中加入一定体积的水再加入浓硫酸,配置准确浓度的稀硫酸
E.知趣乙酸乙酯时,加热前应先向试管中加入碎瓷片
II、无水氯化铝为白色粉末,极易吸水,常压下182.7℃升华.学生甲拟选用如图所示仪器、装置(部分仪器连接的橡胶管或橡胶塞省略)和试剂制备无水氯化铝.
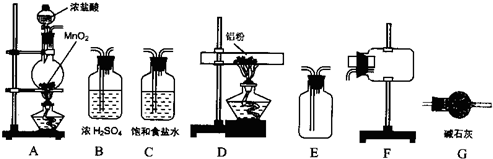
回答下列问题
(2)实验前,如何检查装置A的气密性
关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水.然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气
关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水.然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气
.
(3)装置A中反应的化学方程式为
4HCl(浓)+MnO
2 MnCl
2+Cl
2↑+2H
2O
4HCl(浓)+MnO
2 MnCl
2+Cl
2↑+2H
2O
.
(4)从上列仪器中选取制备无水氯化铝的装置,各装置的连接顺序为:
A→
C
C
→
B
B
→
D
D
→
F
F
→G
(5)装置G的作用是
吸收多余的氯气,同事防止空气中水蒸气进入到装置中使氯化铝水解
吸收多余的氯气,同事防止空气中水蒸气进入到装置中使氯化铝水解
.
(6)学生乙提出另一种制备无水氯化铝的方案:将金属铝与足量盐酸反应后,将溶液加热蒸干、灼烧的到无水氯化铝.请你评价该方案是否可行,并说明理由
不可行,AlCl3在水中存在如下平衡:AlCl3+3H2O=Al(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3=Al2O3+3H2O↑,因此固体产物主要为Al2O3
不可行,AlCl3在水中存在如下平衡:AlCl3+3H2O=Al(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3=Al2O3+3H2O↑,因此固体产物主要为Al2O3
.

 (2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段:
(2009?深圳二模)甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段: