
题目列表(包括答案和解析)
将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:3A(气) + B(气)  xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白:
xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白:
(1) x =______
(2) 平衡时C的浓度为 ________________
(3) 平衡时B的转化率为 _____________
(4) 平衡时,容器内的压强与原容器内压强的比值为 ___________
将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:3A(气) + B(气) 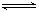 xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白:
xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白:
(1) x =______
(2) 平衡时C的浓度为 ________________
(3) 平衡时B的转化率为 _____________
(4) 平衡时,容器内的压强与原容器内压强的比值为 ___________
将3 mol A和2.5 mol B混合于2L的密闭容器中,发生反应的化学方程式为:
3A(气) + B(气) ![]() xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白:
xC(气) + 2D(气),5 min后反应达到平衡状态,容器内的压强变小,已知D的平均反应速度为 0.1 mol/(L﹒min), 填写下列空白:
(1) x =______
(2) 平衡时C的浓度为 ________________
(3) 平衡时B的转化率为 _____________
(4) 平衡时,容器内的压强与原容器内压强的比值为 ___________
| ||
| 高温高压 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
| 1 |
| 4 |
 3C(g),已知加入1molA和3molB,平衡时A的物质的量为a mol.
3C(g),已知加入1molA和3molB,平衡时A的物质的量为a mol.| (3-3a) |
| (3+a) |
| (3-3a) |
| (3+a) |
| p |
| 3 |
| p |
| 3 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com