
题目列表(包括答案和解析)
| 实验步骤 | 预期现象和结论 |
| ①取铜与浓硫酸反应所得的绿色溶液于试管中,多次震荡,静置 ②取铜与稀硝酸反应所得的蓝色溶液通NO2气体 ③ |
溶液颜色由绿色转变为深蓝色,证明假设二成立 蓝色溶液变成绿色,证明假设二成立 |
(8分)有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝
片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1
的NaOH溶液中,如下图所示。
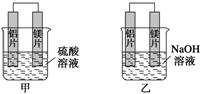
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
(3)甲同学又将硫酸溶液换为浓硝酸发现有红棕色气体产生,则原电池的正极的电极反应式为
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________________(如可靠,此空可不填)。
(8分)有甲、乙两位学生均想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝
片作电极,但甲同学将电极放入6 mol·L-1 H2SO4溶液中,乙同学将电极放入6 mol·L-1
的NaOH溶液中,如下图所示。
(1)写出甲池中正极的电极反应式:
正极:____________________________________________________________。
(2)写出乙池中负极的电极反应式和总反应的离子方程式:
负极:________________________________________________________________。
(3)甲同学又将硫酸溶液换为浓硝酸发现有红棕色气体产生,则原电池的正极的电极反应式为
(4)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出________活动性更强,而乙会判断出________活动性更强(填写元素符号)。
(5)由此实验,可得到如下哪些正确结论?( )
A.利用原电池反应判断金属活动顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动顺序表已过时,已没有实用价值
D.该实验说明化学研究对象复杂、反应受条件影响较大,因此应具体问题具体分析
(6)上述实验也反过来证明了“直接利用金属活动顺序表判断原电池中的正负极”这种做法________(可靠或不可靠)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_________________________________________________________________(如可靠,此空可不填)。
甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
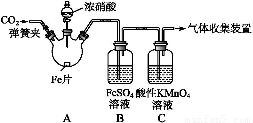
文献记载:Ⅰ.在浓硝酸与活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。
Ⅱ.FeSO4+NO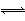 Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。
Ⅲ.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 |
|
打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
请回答下列问题:
(1)滴入浓硝酸加热前没有明显现象的原因是 。
(2)检验是否生成-3价氮的化合物,应进行的实验操作是 。
(3)甲取少量B中溶液,加热,实验现象是 。请用化学平衡原理解释原因: 。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是 ,证明有NO生成的实验现象是 。
(5)证明A溶液中含有Fe3+,选择的药品是(填序号) 。
A.铁粉?? B.溴水????? C.铁氰化钾溶液D.硫氰化钾溶液
已知硝酸锏溶液颜色为蓝色.某学校化学课外小组同学们在做铜与浓硝酸、稀硝酸反应的实验中,发现铜和浓硝酸反应后溶液为绿色旦有红棕色气体产生,而铜和稀硝酸反应后溶液为蓝色,产生无色气体.为弄清反应后溶液颜色出现差异的原因,他们进行了实验探究.
【实验】在两支试管中各放入一小块等质量的铜片,分别加人等体积的浓HN03(14 mol•
L-1)和稀HN03(4mol . L-1 ), 立即用蘸有NaOH的棉花封住试管口。充分反应后铜均无剩余。
(1) Cu与浓HNO3反应的离子方程式______________________________
(2) 用蘸有NaOH的棉花封住试管口的原因________________
【提出假设】假设一、因为铜离子浓度大造成的。
假设二、溶液呈绿色是因为铜与浓硝酸反应时产生的二氧化氮溶于过量浓硝酸,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。
【设计实验方案,验证假设】
(3) 上述实验________(“能”或“不能”)证明假设一不成立,原因________________
(4) 甲同学设计实验验证假设二,请帮他完成下表中内容(提示:NO3-在不同条件下的还原产物较复杂,有时难以观察到气体产生)

(5)铜和稀硝酸反应后溶液为蓝色的原理_______________ _
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com