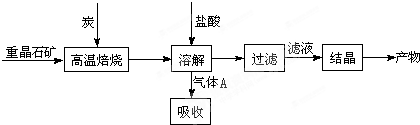
以钡矿粉(主要成份为BaCO
3,含有Ca
2+、Fe
2+、Fe
3+、Mg
2+等)制备BaCl
2?2H
2O的流程如下:

(1)氧化过程主要反应的离子方程式为
H2O2+2Fe2++2H+=2Fe3++2H2O
H2O2+2Fe2++2H+=2Fe3++2H2O
.
(2)沉淀C的主要成分是Ca(OH)
2和
Mg(OH)2
Mg(OH)2
.由图可知,为了更好的使Ca
2+沉淀,还应采取的措施为
提高温度
提高温度
.

(3)用BaSO
4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6g BaCl
2?2H
2O试样,加入100ml 水,3mL 2mol?L
-1 的HCl溶液加热溶解.
步骤2:边搅拌,边逐滴加入0.1mol?L
-1 H
2SO
4溶液.
步骤3:待BaSO
4沉降后,
加入0.1mol?L-1 H2SO4溶液
加入0.1mol?L-1 H2SO4溶液
,确认已完全沉淀.
步骤4:过滤,用0.01mol?L
-1的稀H
2SO
4洗涤沉淀3~4次,直至洗涤液中不含Cl
-为止.
步骤5:将折叠的沉淀滤纸包置于
坩埚
坩埚
中,经烘干、炭化、灰化后在800℃灼烧至恒重.称量计算BaCl
2?2H
2O中Ba
2+的含量.
①步骤3所缺的操作为
向上层清液中加入1~2滴0.1mol/LH2SO4溶液
向上层清液中加入1~2滴0.1mol/LH2SO4溶液
.
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为
称取试样过少,沉淀量就少,洗涤造成的损失就大
称取试样过少,沉淀量就少,洗涤造成的损失就大
.
③步骤5所用瓷质仪器名称为
坩埚
坩埚
.滤纸灰化时空气要充足,否则BaSO
4易被残留的炭还原生成BaS,该反应的化学方程式为
BaSO4+4C=4CO+BaS或BaSO4+2C=2CO2+BaS
BaSO4+4C=4CO+BaS或BaSO4+2C=2CO2+BaS
.
④有同学认为用K
2CrO
4代替H
2SO
4作沉淀剂效果更好,请说明原因
BaCrO4的摩尔质量大于BaSO4
BaCrO4的摩尔质量大于BaSO4
.
[已知:Ksp(BaSO
4)=1.1×10
-10 Ksp(BaCrO
4)=1.2×10
-10].