(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
甲同学:为制备消毒液,探究并制作了一种家用环保型消毒液(NaClO溶液)发生器,设计了如图1所示的装置,用石墨作电极电解饱和氯化钠溶液.
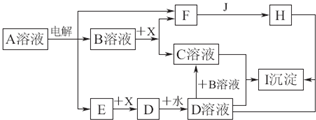
请完成下列问题:若通电时,为使生成的Cl
2被完全吸收,制得有较强杀菌能力的消毒液,则电源的a电极名称为
负
负
极(填“正”、“负”、“阴”或“阳”),与其相连的电极的电极反应式为
2H++2e-→H2↑
2H++2e-→H2↑
;装置溶液中反应生成NaClO的离子方程式为
Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.
乙同学:从某超市中查询到某品牌消毒液包装说明的部分内容摘录如下:
主要有效成份为次氯酸钠,有效氯含量8000-10000mg/L.可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用.切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品.本品须密封,置阴凉暗处保存.
请完成以下实验探究过程:
Ⅰ.阅读材料,根据学过的知识判断问题
(1)室温条件下,该消毒液(NaClO)溶液的pH
>
>
7(填“>”、“<”或“=”),
原因是(用离子方程式表示)
ClO-+H2O?HClO+OH-
ClO-+H2O?HClO+OH-
.
(2)该消毒液还具有的化学性质是
A、D
A、D
(填序号).
A.强氧化性 B.强还原性 C.不稳定性 D.漂白性 E.弱酸性
Ⅱ.确定要研究的问题
该消毒液对碳钢制品的腐蚀原理.
Ⅲ.设计方案,实施探究
(1)用烧杯取少量样品,将一颗光亮的普通碳钢钉放入烧杯,浸泡一段时间.预期的实验现象是
钢钉表面有红褐色物质生成
钢钉表面有红褐色物质生成
.
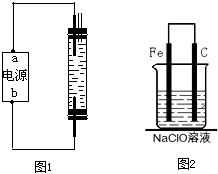
(2)为了进一步探究碳钢钉在该消毒液(NaClO)中的腐蚀原理,丁同学设计了如图2实验装置,写出碳(C)极上发生的电极反应式
ClO-+2e-+H2O→Cl-+2OH-
ClO-+2e-+H2O→Cl-+2OH-
.



 (2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究.
(2010?烟台一模)2008年5月12日我国四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒液,如NaClO溶液.某校探究性学习小组对消毒液次氯酸钠(NaClO)的制备与性质等进行了探究. A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题: