(2013?江苏三模)乙二酸(H
2C
2O
4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
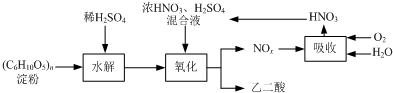
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO
3、H
2SO
4混合液,可发生下列反应:
C
6H
12O
6+18HNO
3→3H
2C
2O
4+18NO
2↑+12H
2O
C
6H
12O
6+6HNO
3→3H
2C
2O
4+6NO↑+6H
2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为
取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热,若有砖红色沉淀产生,说明含有葡糖
取氧化后所得溶液,加入过量NaOH溶液,再向其中加入新制Cu(OH)2,加热,若有砖红色沉淀产生,说明含有葡糖
.
(2)氧化时控制反应液温度为55~60℃的原因是
温度过低反应过慢,若温度过高硝酸会分解(或挥发)
温度过低反应过慢,若温度过高硝酸会分解(或挥发)
.
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中.则30kg淀粉可生产乙二酸的质量为
28.8kg
28.8kg
.
(4)生产中产生的NO
x用氧气和水吸收后产生硝酸循环利用,若尾气NO
x中n(NO
2):n(NO)=2:1,且NO
x的吸收转化率为90%.计算:理论上,每生产9kg 乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克.(写出计算过程)