
题目列表(包括答案和解析)

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Pb(OH)2 | Mn(OH)2 | PbS | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 8.7 | 10.4 | ≥0.1 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各约占2%。
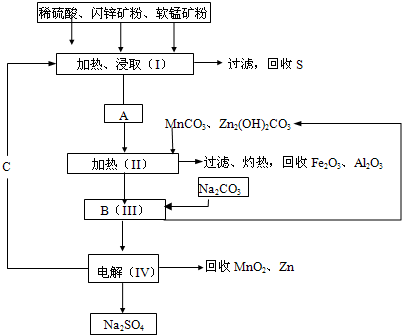
MnO2和Zn是制造干电池的原料。电解法生产MnO2传统的工艺主要流程为:软锰矿加焦炭还原熔烧,用H2SO4浸出熔烧料,浸出液经净化然后电解,在阳极上析出MnO2。
电解制锌的传统工艺为:闪锌矿高温氧化脱硫再还原得粗锌。

将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
90年代生产MnO2和Zn的新工艺是通过电解获得MnO2和Zn。
![]()
![]()
试回答下列问题。
(1)已知在第①步中发生了反应:
MnO2+ZnS+2H2SO4====MnSO4+ZnSO4+S+2H2O
据此写出第①步反应中MnO2和CuS与酸反应的离子方程式:__________,软锰矿中Al2O3溶于酸的离子方程式:______________________________。
(2)产品C为____________,当第③步电解时,电路中通过1 mol电子时,阳极生成__________,其物质的量为__________。
(3)试从环境保护和能量消耗的角度,评价90年代新工艺与传统工艺相比较有哪些优点。
____________________________________________________________________。

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.4 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |
| 电解 |
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com