铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS
2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:3FeS
2+8O
26SO
2+Fe
3O
4,有3mol FeS
2参加反应,转移
32
32
mol电子.
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
;从腐蚀废液回收得到金属铜,还需要的试剂是
铁粉、稀盐酸(稀硫酸)
铁粉、稀盐酸(稀硫酸)
.
(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体
酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体
.
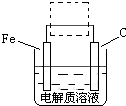
(4)钢铁的电化腐蚀简单示意图如图,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在虚线框内作出修改,并用箭头标出电子流动方向
.

 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:


