
题目列表(包括答案和解析)
(05年北京卷)(18分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3?6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是 。
(2)装置E中的现象是 。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:
(4)该小组学生利用上述滤液制取FeCl3?6H2O晶体,设计流程如下:
滤液→FeCl3溶液→FeCl3?6H2O晶体
①步骤I中通入Cl2的作用是 。
②步骤II从FeCl3稀溶液中得到FeCl3?6H2O晶体的主要操作包括:
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
 |
i.液面上方出现白雾; ⅱ.稍后,出现浑浊,溶液变为黄绿色; ⅲ.稍后,产生大量白色沉淀,黄绿色褪去 |
(06年北京卷)X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
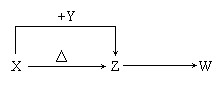
请回答:
(1)W的电子式是_______________________________________。
(2)X与Y在溶液中反应的离子方程式是______________________________。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置III中产生白色沉淀,装置V中可收集到一种无色气体。
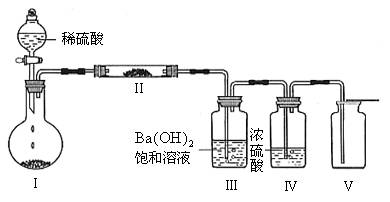
①装置I中反应的化学方程式是_______________________________________,装置II中物质的化学式是_____________________。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置V中气体,该化合物的化学式是_______________,所需仪器装置是_____________(从上图选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是_______________________________________。
①![]() 均与Y的气态氢化物分子具有相同的电子数;
均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物![]() 溶液遇苯酚呈紫色。
溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是_____________。
(2)将![]() 溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________
溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________
______________________________________________,此液体具有的性质是_____________(填写序号字母)。
a. 光束通过该液体时形成光亮的“通路”
b. 插入电极通直流电后,有一极附近液体颜色加深
c. 向该液体中加入硝酸银溶液,无沉淀产生
d. 将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被![]() 氧化放热98.0 kJ。若2 mol该气体与1 mol
氧化放热98.0 kJ。若2 mol该气体与1 mol ![]() 在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为_________。
在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为_________。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有![]() 个电子转移时,该反应的化学方程式是___________________________。
个电子转移时,该反应的化学方程式是___________________________。
(07年北京卷)(15分)北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 |
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol?L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 _______ 。
②b中反应所产生的I2的物质的量是_______ mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)_________mg/kg。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com