
题目列表(包括答案和解析)
浓度/mol?L-1 / 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
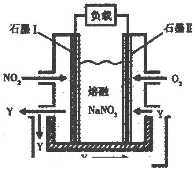
某温度下,C和水在密闭容器中发生下列反应:C(s)+H2O(g)?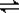 ?CO(g)+H2(g), CO(g)+H2O(g)?
?CO(g)+H2(g), CO(g)+H2O(g)?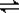 ?CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
?CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
A.0.1 mol/L B.0.9 mol/L
C.1.8 mol/L D.1.9 mol/L
在某一容积为5 L的密闭容器内,加入0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) 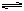 CO2(g)+H2(g)
ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g)
ΔH>0,反应中CO2的浓度随时间变化情况如右图:
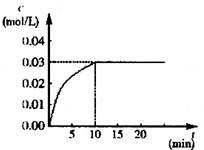
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)= mol/(L·min)-1,
该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 G.移出一氧化碳气体
(3)如要一开始加入0.1 mol的CO、0.1 mol的H2O、0.2 mol的CO2和0.2 mol的H2,在相同的条件下,反应达平衡时,c(CO)=________________mol/L.
(4)若保持温度和容器的体积不变,在(1)中上述平衡体系中,再充入0.3mol 的水蒸气,重新达到平衡后,CO的转化率_______(填“升高”、“降低”还是“不变”),CO2的质量分数________(填“升高”、“降低”还是“不变”).
(5)在催化剂存在和800℃的条件下,在某一时刻测得C(CO)=C(H2O)= 0.09mol/L,
C(CO2 )=C(H2)=0.13mol/L ,则此反应是否处于平衡状态: (填“是”或“否”),若没有处于平衡状态则该反应向 移动。(填“正方向”或“逆方向”)
在某一容积为5 L的密闭容器内,加入0.3 mol的CO和0.3 mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g) 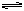 CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图:
CO2(g)+H2(g) ΔH>0,反应中CO2的浓度随时间变化情况如右图: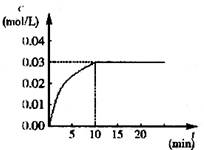
(1)根据图上数据,反应开始至达到平衡时,
CO的化学反应速率为v(CO)= mol/(L·min)-1,
该温度下的平衡常数K= 。
(2)在体积不变的条件下,改变下列条件重新达到平衡时能使平衡常数K增大的有
(填字母)
| A.升高温度 | B.降低温度 | C.增大压强 | D.减小压强 |
某温度下,C和水在密闭容器中发生下列反应:C(s)+H2O(g)??CO(g)+H2(g), CO(g)+H2O(g)?
?CO2(g)+H2(g)当反应达平衡时,测得c(H2)=1.9 mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
A.0.1 mol/L B.0.9 mol/L
C.1.8 mol/L D.1.9 mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com