
题目列表(包括答案和解析)
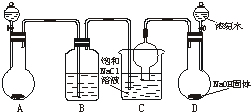 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:(1)在T1℃时,向容积为2L的密闭容器甲中加入1molN2、3 molH2及少量固体催化剂,发生反应N2(g)+3H2(g)![]() 2NH3(g) DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。
2NH3(g) DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为 mol·L-1·min-1,N2的转化率为 。
②在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1molNH3,则达到平衡时NH3的物质的量为 (填选项字母)
A.大于0.4mol B.等于0.4mol C.小于0.4mol
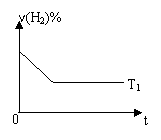 ③右图是在T1℃时密闭容器甲中H2的体积分数随时间t的
③右图是在T1℃时密闭容器甲中H2的体积分数随时间t的
变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2
体积分数随时间t的变化曲线。
(2)明矾可做净水剂是因为(用离子方程式表示) ;
向明矾的水溶液中加入饱和的小苏打溶液发生反应的离子
方程式为 。
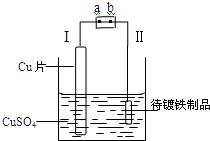 右图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是( )
右图是在待镀铁制品上镀铜的实验装置,则下列说法正确的是( )(10分)(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ(25℃时),写出表示N2H4燃烧热的热化学方程式 。
(2)甲烷----氧气燃料电池以20%~30%的KOH溶液为电解质溶液。
正极的电极反应式是 。
负极的电极反应式是 。
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ(25℃时),写出表示N2H4燃烧热的热化学方程式 。
(2)甲烷----氧气燃料电池以20%~30%的KOH溶液为电解质溶液。
正极的电极反应式是 。
负极的电极反应式是 。
(3)右图是一个电化学过程示意图。
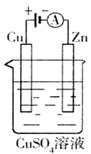
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com