
题目列表(包括答案和解析)
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g)  NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。

①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①下列选项可以判断该分解反应达到平衡的是________。
A.
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变ΔH______0(填 “>”、“=”或“<”),25.0℃时分解平衡常数的值=__________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将_________(填“增加”,“减少”或“不变”)。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g)  NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。

①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积
忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度(×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①下列选项可以判断该分解反应达到平衡的是________。
A.
B.密闭容器内物质总质量不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②该分解反应的焓变ΔH______0(填“>”、“=”或“<”)。
25.0℃时的分解平衡常数的值=__________________________。
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡。若在恒温下压缩容器体积,氨基甲酸铵固体的质量将_________(填“增加”,“减少”或“不变”)。
(4)图2中反应器用冰水冷却的原因是_____________________________________。
氨基甲酸铵(NH2COONH4)是一种白色固体,易分解、易水解,可用做肥料、灭火剂、洗涤剂等。某化学兴趣小组模拟制备氨基甲酸铵,并探究其分解反应平衡常数。反应的化学方程式: 2NH3(g)+CO2(g) NH2COONH4(s)。请按要求回答下列问题:
NH2COONH4(s)。请按要求回答下列问题:
(1)请在下图1方框内画出用浓氨水与生石灰制取氨气的装置简图。
(2)制备氨基甲酸铵的装置如下图2所示。生成的氨基甲酸铵小晶体悬浮在四氯化碳中。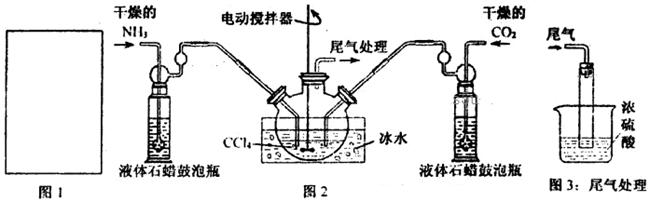
①从反应后的混合物中分离出产品的实验方法是_____________(填操作名称)。
②上图3中浓硫酸的作用是_______________________________________。
(3)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积
忽略不计),在恒定温度下使其达到分解平衡。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
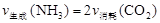
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
|
| Fe3+ | Al3+ | Fe2+ | Mg2+ |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
|
| 平行测定数据 | 平均值 | |||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
① 根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s) Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)= 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
(12分)蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
I.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤;并在常温常压下结晶,制得粗硫酸镁
(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)。
II.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1 mol/L H2O2溶液,再
调节溶液pH至7~8,并分离提纯。
III.制取氢氧化镁:向步骤II所得溶液中加入过量氨水。
已知:金属离子氢氧化物沉淀所需pH
|
|
Fe3+ |
Al3+ |
Fe2+ |
Mg2+ |
|
开始沉淀时 |
1.5 |
3.3 |
6.5 |
9.4 |
|
沉淀完全时 |
3.7 |
5.2 |
9.7 |
12.4 |
请回答:
(1)步骤II中,可用于调节溶液pH至7~8的最佳试剂是 (填字母序号)。
A. MgO B. Na2CO3 C.蒸馏水
(2)工业上,常通过测定使铁氰化钾(K3[Fe(CN) 6])溶液不变色所需H2O2溶液的量来确
定粗硫酸镁中Fe2+的含量。已知,测定 123 g粗硫酸镁样品所消耗的0.1 mol/L H2O2
溶液的体积如下表所示。
|
|
平行测定数据 |
平均值 |
|||
|
实验编号 |
1 |
2 |
3 |
4 |
|
|
消耗H2O2溶液的体积/mL |
0.32 |
0.30 |
0.30 |
0.32 |
0.31 |
Fe2+与H2O2溶液反应的离子方程式为 。
(3)工业上常以Mg2+的转化率为考察指标,确定步骤III制备氢
氧化镁工艺过程的适宜条件。其中,反应温度与Mg2+转化率
的关系如右图所示。
① 根据图中所示 50℃前温度与Mg2+转化率之间的关系,可判 断此反应是 (填“吸热”或“放热”)反应。
②图中,温度升高至 50℃以上Mg2+转化率下降的可能原因 是 。
③Ksp表示沉淀溶解平衡的平衡常数。已知:
Mg(OH)2(s)  Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(
OH-) = 5.6×10-12
Mg2+ (aq)+ 2OH- (aq) Ksp = c(Mg2+)·c2(
OH-) = 5.6×10-12
Ca(OH)2(s) Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
Ca2+ (aq) + 2OH- (aq) Ksp = c(Ca2+)·c2(OH-)
= 4.7×10-6
若用石灰乳替代氨水, (填“能”或“不能”)制得氢氧化镁,理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com