
题目列表(包括答案和解析)
(08上海松江区期末)(1)芳香醛(如糠醛)在碱作用下,可以发生如下反应:
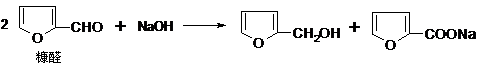
(2)不饱和碳碳键上连有羟基不稳定。
(3)化合物A~F之间的转化关系如下图所示。其中,化合物A含有醛基,E与F是同分异构体,F能与金属钠反应放出氢气。A生成F的过程中,A中醛基以外的基团没有任何变化。
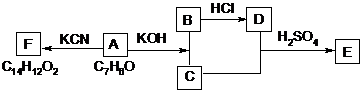
据上述信息,回答下列问题:
(1)写出A生成B和C的反应式:
(2)写出C和D生成E的反应式:
(3)F结构简式是:
(4)A生成B和C的反应是( ),C和D生成E的反应是( )
A、氧化反应 B、加成反应 C、消去反应 D、酯化反应 E、还原反应
(5)F不可以发生的反应有( )
A、氧化反应 B、加成反应 C、消去反应 D、酯化反应 E、还原反应
 13.
13.
(扬州期末)如图所示,L1和L2为平行的虚线,L1上方和L2下方都是垂直纸面向里的磁感应强度相同的匀强磁场,AB两点都在L2上.带电粒子从A点以初速v与L2成300斜向上射出,经过偏转后正好过B点,经过B点时速度方向也斜向上,不计重力,下列说法中正确的是
A.带电粒子经过B点时的速度一定跟在A点的速度相同
B.若将带电粒子在A点时的初速度变大(方向不变)它仍能经过B点
C.若将带电粒子在A点时初速度方向改为与L2成600角斜向上,它就不一定经过B点
D. 粒子一定带正电荷
 14.
14.
(扬州期末15分)倾斜雪道的长为50 m,顶端高为30 m,下端经过一小段圆弧过渡后与很长的水平雪道相接,如图所示。一滑雪运动员在倾斜雪道的顶端以水平速度v0=10 m/s飞出,在落到倾斜雪道上时,运动员靠改变姿势进行缓冲使自己只保留沿斜面的分速度而不弹起。除缓冲外运动员可视为质点,过渡轨道光滑,其长度可忽略。设滑雪板与雪道的动摩擦因数μ=0.2,求:
(1)运动员落在倾斜雪道上时与飞出点之间的距离;
(2)运动员落到倾斜雪道瞬间沿斜面的速度大小;
(3)运动员在水平雪道上滑行的距离(取g=10 m/s2)。
15.
(扬州期末15分)如图所示,一边长L = 0.2m,质量m1 = 0.5kg,电阻R = 0.1Ω的正方形导体线框abcd,与一质量为m2 = 2kg的物块通过轻质细线跨过两定滑轮相连。起初ad边距磁场下边界为d1 = 0.8m,磁感应强度B=2.5T,磁场宽度d2 =0.3m,物块放在倾角θ=53°的斜面上,物块与斜面间的动摩擦因数μ=0.5。现将物块由静止释放,经一段时间后发现当ad边从磁场上边缘穿出时,线框恰好做匀速运动。(g取10m/s2,sin53°=0.8,cos53°= 0.6)求:
(1)线框ad边从磁场上边缘穿出时绳中拉力的功率;
(2)线框刚刚全部进入磁场时速度的大小;
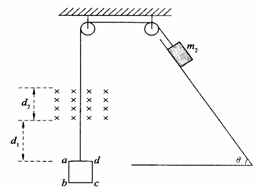 (3)整个运动过程中线框产生的焦耳热。
(3)整个运动过程中线框产生的焦耳热。

| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| Cu |
| △ |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com