
题目列表(包括答案和解析)

(10分)从今年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从绍兴、宁波、台州地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素。
I.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为40 mg/kg,要达到上述碘含量要求,需服用该碘盐 ▲ kg,你觉得服用碘盐防辐射合理吗? ▲
 II.右图为某加碘盐标签的一部分。
II.右图为某加碘盐标签的一部分。
已知:①KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
②I2+2Na2S2O3=2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以
下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移
至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄色,再加入3滴淀粉溶液。
步骤2:取一支50mL碱式滴定管,用bmol·L-1的新制Na2S2O3 溶液润洗2~3次后,装满溶液,调节液面高度至0刻度。
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
|
编号 |
碱式滴定管读数 |
消耗体积(mL) |
|
|
滴定前刻度 |
滴定后刻度 |
||
|
1 |
0 |
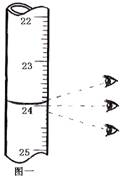
如图一 |
|
|
2 |
0 |
23.98 |
23.98 |
|
3 |
0 |
24.02 |
24.02 |
(1)第一次读数为 ▲ mL。
(2)滴定终点的判断方法 ▲ 。
(3)经过计算,此加碘盐碘元素的含量为 ▲ mg/kg(用包含a、b的最简表达式表示)。
(4)下列操作可能会导致测量结果偏低的是 ▲ 。
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失
1.A 2.B 3.D 4.A 5.A 6.B 7.B 8.C 9.D 10.C 11.A 12.C
13.(第一空2分,其余空各1分,共6分)
反应物原子间有电子转移 得 降低 还原 还原
14.(空各2分,共6分)②⑦ ①⑧ ④⑤
15.(方程式各3分,共6分)
(1)CaCO3 + 2H+ = Ca2++ 2H2O + CO2↑
(2)Cu2++ SO42- + Ba2++ 2OH-== Cu(OH)2↓+ BaSO4↓
16.(方程式各3分,共6分)
(1)Na2CO3 + 2HC1 = CO2↑+ H2O + 2NaC1
(2)AgNO3+ HC1 = AgC1↓+ HNO3
17.(每小题各2分,共8分) 略。
18.(空各2分,方程式各3分,共14分)
(1)Na2CO3、BaCl2、AgNO3、HCl
(2)CO32- + 2H+ = CO2↑+ H2O ; Ag+ + C1- = AgC1↓
19.(空各3分,共6分) 7.1 7.3
第二章 参考答案
1.B 2.A 3. B 4. C 5. C 6. D 7. C 8. D 9. C 10.B 11.A 12. A
13.银白; Na2O2; 黄; 软;2Na+2H2O=2NaOH+H2↑;(略);Fe3++3OH-=Fe(OH)3↓;
产生红褐色沉淀。
14.风化; 潮解; Na2CO3; 不变。
15.Na+>K+>Rb+; 还原; Rb、K、Na。
16.HCO3-+H+=H2O+CO2↑; 2OH-+CO2=CO32-+H2O; CO32-+H2O+CO2=2HCO3-
17.(1)ac (2)①FeCl3; 2Fe3++Fe=3Fe2+,防止Fe2+被氧化成Fe3+
②产生白色沉淀,迅速变成灰绿色,最终变为红褐色沉淀;4Fe(OH)2+O2+2H2O=4Fe(OH)3。
(3)Al(OH)3, Al(OH)3+OH-=AlO2-+2H2O或Al(OH)3+3H+=Al3++3H2O。
第三章 参考答案
16.18.4%
17.
第四章 参考答案
1.D 2.C 3.C 4.C 5.B 6.C 7.C
8.B 9.C 10.D 11.B 12.D 13.D 14.A
15.③④②①; ④③①②; ④③①②; ③②④①; ④③②①;
16.(1) E C D A B H G F
(2)MnO2+4HCl
(浓)  MnCl2+Cl ↑+2H2O
MnCl2+Cl ↑+2H2O
(3)①除去Cl3中的HCl气体 ②除去Cl2中混有的水蒸气
(4)Cl2+2OH-=Cl-+ClO-+H2O
17.(1)
第五章 参考答案
1.C 2.C 3.B 4.B 5.C 6.B 7.B 8.C 9.C 10.B
11.互为同位素 1:2:3 1:1:1 1:1:1
12.Na2O K2S MgF2 CaCl2
13.(1)A:氧 B:磷 C:硫 D:氯 E:铝
(2) A离子: C原子:
C原子:
(3) 极性
(4)先有白色沉淀产生并逐渐增多,随NaOH加入又逐渐溶解最终澄清
Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O
14.(1)A B
(2) ① Cl2+H2O = H+ + Cl‑ + HClO ② 略 ③ 2K2O2+2CO2=2K2CO3+O2
第六章 参考答案
1.B 2.B 3.D 4.D 5.B 6.A 7.B 8.B 9.C 10.D
11.
(1)氧化 (2)还原 (3)
12.(1)①如图配置

②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加。
(2)①溶液褪色 ②溶液褪色 ③有浅黄色沉淀(或溶液变浑浊)
(3)①NaSO3 变质 取待测试样于试管中,加适量蒸馏水配成溶液,先滴入足量稀盐酸,再
滴入BaCl2 ,溶液有白色沉淀生成,则证明该NaSO3 固体变质
②不是浓硫酸 用洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫酸
13. (1) O2
(1) O2
(2)C + 2H2SO4 (浓) 2SO2 + CO2↑+ 2H2O
(3)CO + 2H+
+ 2H+ CO2↑+
H2O SO2 + Cl2 + 2H2O
4H + + SO + 2Cl ?
+ 2Cl ?
第七章 参考答案
1.D 2.C 3.D 4.B 5.B 6.C 7.D 8.A 9.C 10.C 11.C
12. (1)a、c、d、e? (2)浓HNO3、水、块状大理石
13. (1)B装置中导气管长进短出
(2)①Cu + 2H2SO4(浓) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
②反应过程中H2SO4被不断消耗,生成的水逐渐增多,使浓硫酸逐渐变稀,至一定浓度就不再与铜片反应;
③A、D
14.解:⑴ Cu+2H2SO4(浓) CuSO4
+SO2↑+2H2O ⑵Cu
CuSO4
+SO2↑+2H2O ⑵Cu H2SO4
H2SO4  CuSO4
CuSO4
6
⑶c(CuSO4)======0.2mol?L-1 答:(略)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com