
题目列表(包括答案和解析)
 请回答下列问题:
请回答下列问题:A已知:A、B、C、D、E为周期表1~36号中的元素,它们的原子序数逐渐增大。A的基态原子有3个不同的能级,各能级中电子数相等;C的基态原子2p能级上的未成对电子数与A原子相同;C2—离子D2+离子具有相同的、稳定的电子层结构;E的基态原子的外围电子排布式为3d84s2。
 请回答下列问题:
请回答下列问题:
⑴A、B、C、D四种元素中,电负性最大的是 ▲ (填元素符号)。
⑵B的氢化物的沸点远高于A的氢化物的主要原因是 ▲ 。
 ⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑶由A、B、C形成的离子CAB-与AC2互为等电子体,则CAB-中A原子的杂化方式为 ▲ 。
⑷E2+离子能与AC分子形成[E(AC)4]2+,其原因是AC分子中含有 ▲ 。
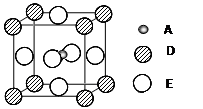
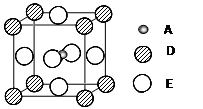
⑸最近发现,只含A、D、E三种元素的一种晶体(晶胞如右图所示)具有超导性。A原子的配位数为 ▲ ;该晶体的化学式为 ▲ 。
CaC2和MgC2都是离子化合物,下列叙述正确的是
A.MgC2和CaC2都能跟水反应生成乙炔
B.C![]() 的电子式为[∶C┋┋C∶]2-
的电子式为[∶C┋┋C∶]2-
C.CaC2在水中以Ca2+和C![]() 形式存在
形式存在
D.MgC2的熔点低,可能在100 ℃以下
铜及其合金是人类最早使用的金属材料。
⑴铜原子的核外电子排布式是 ▲ 。
⑵铜的熔点比钙高,其原因是 ▲ ;右图是金属Ca和Cu所形成的某种合金的晶胞结构示意图,则该合金中Ca和Cu的原子个数比为 ▲ 。
⑶Cu2+能与NH3、H2O、Cl-等形成配位数为4的配合物。
①[Cu(NH3)4]2+中存在的化学键类型有 ▲ (填序号)。
A.配位键 B.金属键 C.极性共价键 D.非极性共价键 E.离子键
②[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 ▲ 。
③某种含Cu2+的化合物可催化丙烯醇制备丙醛的反应:HOCH2CH=CH2→CH3CH2CHO。在丙烯醇分子中发生某种方式杂化的碳原子数,是丙醛分子中发生同样方式杂化的碳原子数的2倍,则这类碳原子的杂化方式为 ▲ 。
| A.MgC2和CaC2都能跟水反应生成乙炔 |
B.C 的电子式为[∶C┋┋C∶]2- 的电子式为[∶C┋┋C∶]2- |
C.CaC2在水中以Ca2+和C 形式存在 形式存在 |
| D.MgC2的熔点低,可能在100 ℃以下 |
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
D
A
A
C
B
A
B
D
题号
11
12
13
14
15
16
17
18
19
20
答案
A
C
D
C
C
A
D
D
D
B
二、填空题
21.CH4+2O2.files/image015.gif) CO2+2H2O,C3H8+5O2
CO2+2H2O,C3H8+5O2.files/image015.gif) 3CO2+4H2O。
3CO2+4H2O。
缩小进风(通空气)管口径或扩宽进气(CH4)管口径。
因空气过量,会把燃料放出的热量带走而损失。
22.(1)Al2O3 (2)(NH4)2SO4、K2SO4
(3)2AlO.files/image017.gif) +CO2+3H2O===
2Al(OH)3↓+CO32-
+CO2+3H2O===
2Al(OH)3↓+CO32-
23.(1)CH2=CH2+Cl2.files/image019.gif) CH2Cl-CH2Cl
(加成)
CH2Cl-CH2Cl
(加成)
.files/image020.gif)
.files/image021.gif)
.files/image022.gif) (2)nCH3-CH=CH2
(2)nCH3-CH=CH2.files/image019.gif) CH-CH 2 n (加聚)
CH-CH 2 n (加聚)
CH3
.files/image023.gif)
.files/image024.gif) (3)
+HO―SO3H
(3)
+HO―SO3H.files/image026.gif) ―SO3H+H2O (取代)
―SO3H+H2O (取代)
.files/image027.gif) |
(4) -CH3 +3HONO2.files/image029.gif) O2N- -CH3 +3H2O (取代)
O2N- -CH3 +3H2O (取代)
三、实验题
24.溴水或酸性KMnO4溶液;NaOH溶液。
25.(1)盐酸(2)铁(3)氢氧化钠
26.(1)酸性KMnO4溶液或溴水
.files/image030.gif) (2)①酸性KMnO4溶液或溴水 ②完全相同;同一平面。
(2)①酸性KMnO4溶液或溴水 ②完全相同;同一平面。
(3)不同, 不同于 (4)
四、计算题
27.(1)混合气相对分子质量=28.5×2=57,
可推知x为C4H10(相对分子质量58);
Y则为C4H8或C4H6(相对分子质量56或54)
(即“①C4H10与C4H
(2)①若为C4H10与C4H8则得V(C4H10): V(C4H8)=1 : 1
②若为C4H10与C4H6则得V(C4H10): V(C4H6)=3:1 (2分)
28.解答:据图所示(1)x=0.4,则n(Al3+)=0.4×0.1 mol=0.04 mol,Fe3+=0.1 mol-0.4×0.1 mol=0.06 mol
.files/image032.jpg)
由反应
Fe3+ + 3OH-===Fe(OH)3↓
0.06 mol→0.18 mol 0.06 mol
Al3+
+ 4OH-===AlO.files/image034.gif) +2H2O
+2H2O
0.04 mol→0.16 mol
余n(OH-)=
所以有0.06 mol Fe(OH)3沉淀。 (3分)
(2)要使沉淀中无Al(OH)3,至少需n(OH-)=4×0.1 x mol
x为最大取值时,有0.1(1-x)×3 mol+0.4x mol=0.09×4 mol x=0.6
所以在0≤x≤0.6时,沉淀只有Fe(OH)3
x=0,Fe(OH)3沉淀为0.1 mol
x=0.4,Fe(OH)3沉淀为0.06 mol
x=0.6,Fe(OH)3沉淀为0.04 mol
在0.6≤x≤1内沉淀总量n=0.1 mol-(0.09×4-0.1×3) mol=0.04 mol (4分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com