
题目列表(包括答案和解析)
下图为向25mL 0.1 mol?L-1 NaOH溶液中逐滴滴加0.2 mol?L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:
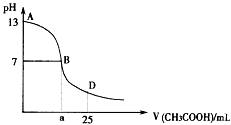
(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,
这种看法是否正确? (选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)
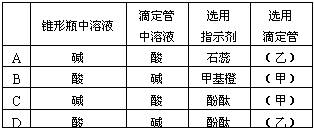
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)

(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系是
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。
(填“>”、“<”或“=”)
25℃时,在浓度为1 mol?L-1的(NH4)2SO4、(NH4)2 CO3、(NH4)2Fe(SO4)2的溶液中,测得c(NH4+)分别为a、b、c(单位为mol?L-1)。下列判断正确的是
A.a=b=c B.a>b>c C.a>c>b D.c>a>b
t℃时,将2 mol SO2和1 mol O2通入体积为2 L的恒温恒容密闭容器中,发生如下反应:![]()
![]()
![]() ;△H=-196kJ?mol一1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2 kJ。请填写下列空白:
;△H=-196kJ?mol一1。2min时反应达到化学平衡,此时测得反应放出的热量为39.2 kJ。请填写下列空白:
(1)下列叙述能证明该反应已经达到化学平衡状态的是(填标号;下同)
A.容器内压强不再发生变化 B.SO2的体积分数不再发生变化
C.容器内气体质量不再发生交化 D.容器内气体密度不再发生变化
(2)从反应开始至达到化学平衡,生成SO3平均反应速率为 ;平衡时混合气体中SO3的物质的量分数为 。
(3)反应达到化学平衡后,以下操作将引起平衡向正反应方向移动并能提高SO2转化率的是
A.向容器中通入少量O2 B.向容器中通入少量SO2
C.使用催化剂 D.降低温度
E.向容器中通入少量氦气
(4)上述反应达平衡后,判断下列情况下平衡移动的方向(填“向右”、“向左”或“不”).
①再通入1.6molSO2、0.8molO2、0.4molSO3,
②再通入0.2molSO2、0.2molSO3,
(5分)(1)将0.15mol?L-1稀硫酸V1mL与0.1 mol?L-1NaOH溶液V2mL混合,所得溶液的pH为1,则V1∶V2= 。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,据题意,回答下列问题。
①若由0.1mol?L-1HA溶液与0.1mol?L-1NaOH溶液等体积混合而得,则溶液的pH 7(选填“大于或等于”、 “小于或等于”、 “等于”)。
②若溶液pH>7,则c (Na+) c(A-)(选填“>”、 “<”、 “=”)。
③若由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL。混合而得,则下列说法中,正确的是 (填选项符号字母)
A.若反应后溶液呈中性,则反应后溶液中[H+]+ [OH-]=2×10-7mol?L-1
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(7分)现要配制500 ml、O.2 mol?L-1的硫酸溶液:
(1)需用质量分数为98%、密度为1.84 g?cm-3的浓硫酸 mL。
(2)完成该实验需要的玻璃仪器主要有烧杯、量筒、 、 、 。
(3)下列操作使所配溶液的物质的量浓度偏高的是 。
A.往容量瓶中转移溶液时。有少量液体溅出
B.未洗涤烧杯
C.定容时俯视刻度线
D.洗净容量瓶未干燥即用来配制溶液
E.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
一、 选择题(每题2分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
答案
D
B
C
A
B
C
C
B
C
A
C
C
D
题号
14
15
16
17
18
19
20
21
22
23
24
25
答案
A
C
D
D
D
A
D
D
A
D
A
C
二、填空题(本题包括6小题,共计30分)
26. O2+2H2O+4e-=4OH- (1分) 略 (2分)
27. ⑦③⑨①②④⑧⑥⑤ (2分)
28. n-1 (2分)
29.(1)其它离子也沉淀 (1分)
(2)把Fe2+氧化成Fe3+ ;(1分) 增大;(1分) 不妥(1分)引入了钠离子(1分)
(3)BC (2分) (4)CD (2分)
30.(1) 124.24. (1分) (2)2×10-7 mol?L-1; (1分)
(3)> (1分) HCO3-CO32-+H+
HCO3-+H2OH2CO3+OH-、HCO3-的水解程度大于电离程度 (2分)
31.(1)Y (1分) a和c (1分)
(2)0.04 mol?L-1min ; (1分)Kb=(mol?L-1)-1(或mol-1?L); (1分)= (1分)
(3)a,b C(2分) (4)C (2分)
三.实验题(8分)
32. I.无色变红色且半分钟不褪去 (1分) C (1分)
II(1)2MnO4-+10Fe2++16H+=2Mn2++10Fe3++8H2O;(2分)(2) 0.8 mol (2分) (3) AD(2分)
四、计算题(12分)
33、(1)2CuSO4+2H2O=2Cu+O2+2H2SO4 (2分)(2)1.4;(1分) 2:1 (1分)(3)5(2分)
34、(1)消耗的O2物质的量: (1分)
生成的SO3物质的量:
SO2和SO3的物质的量和:
反应前的SO2物质的量: (2分)
SO2的转化率: (1分)
(2)在给定的条件下,溶液呈强酸性,BaSO3不会沉淀。因此BaSO4的质量 (2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com