
题目列表(包括答案和解析)
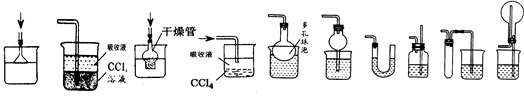
请根据下列装置,回答问题:

 |
(1)写出标号①和②的仪器名称 。
(2)装置B中仪器①的下端管口要浸在液面下,是为了 。
(3)实验室加热暗紫色固体制取O2的反应符号表达式为 ,若用排水法收集气体,当观察到_____ ___时才开始收集;停止实验时,应该_____ _____ _,否则_______________ ____________。
(4)若用装置C、D或K收集O2,要使收集O2干燥且纯净,则应选 装置。若用排水法收集到的O2不纯,可能的原因是?(两条)_____________ ____________、_________________ ___________。
若用向上排空气法收集氧气,如何验满?_________ ____________ _________。
实验过程中发现水槽中的水变成了浅紫红色,可能的操作原因:_____ ___________ 。
(5)用过氧化氢溶液与二氧化锰制取O2,装置G虽然操作简便,但要得到平稳的气流,从H、I、J中选取 取代G中的单孔塞,以达到目的。若选用H与锥形瓶组装的发生装置,当反应停止时,集气瓶中还差少量O2,为集满O2,在不拆卸装置的前提下,可以 、
。实验结束后,该同学发现收集到的气体比预计的少很多,百思不得其解。你认为可能的原因是:___________ ___ _________。
(6)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过以下四步实验操作可回收二氧化锰。正确操作的先后顺序是 (填写选项序号)。
a.烘干 b.溶解 c.过滤 d.洗涤
(7)实验室利用F装置制备氢气,事先将锌粒放于有孔隔板之上,然后从另一端加入稀盐酸,装置F相对于装置B制备氢气,具有的优点是 。若用L装置收集氢气,则气体从 端通入(填“a”或“b”,下同);若要将L装置中的氢气用水排出,则水从 端通入。
 (8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物
(8)查阅资料:实验室常用加热氯化铵(NH4Cl)和熟石灰[Ca(OH)2]两种固体混合物
的方法制取氨气(NH3),同时还生成氯化钙(CaCl2)和水,则该反应的符号表达式为
;另外,氨气有刺激性气味且极易溶于水,则在
实验室里氨气的制取装置是_________。小军设计了如图所示的一个实验:充满氨气的
一支试管倒置于一个装有足量水的烧杯中。一段时间后,将会看到: 。
(9)某化学小组在学习了制取O2后,他们发现在实验室里用5% H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃。同学们经过认真观察,猜想其可能原因是 。
为了验证此猜想是否正确,兴趣小组的同学经过热烈讨论,制定了实验方案并进行了实验。
第一组同学采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,
 一段时间后,用带火星的木条检验,木条复燃;
一段时间后,用带火星的木条检验,木条复燃;
第二组同学在5%的H2O2溶液中加入2滴新制氢氧化钠溶液,加热
一段时间后,用带火星木条检验,木条复燃;
第三组同学从实验装置上进行了改进,效果很好(见图)。
在实验基础上,同学们经过交流讨论,得出了一些结论:
①由第一组实验可得出影响H2O2分解产生O2多少及快慢的因素之一是 ;
②由第二组实验可分析得出氢氧化钠所起的作用可能是 ;
③第三组实验验证了实验前同学们猜想的正确性。其中浓硫酸的作用是 ;
④小李同学认真观察了第三组同学的实验装置,提出了一种简单的改进装置,经现场实验,效果很好,请你说出他改进的地方: 。

空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |




| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |


空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)都是重要的空气质量指标。在工业生产上规定:空气中二氧化硫的最大允许排放浓度不得超过0.02 mg/L。《2004年江苏省环境状况公报》指出:江苏省2004年工业(主要是热电厂)二氧化硫排放总量为1.24×106t,全省酸雨污染比较严重。分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%。
(一)(1)正常的雨水显 性(填:酸、碱、或中),原因是 ;
(2)由于大气中SO2和NOx(NO和NO2)的含量不断升高,并转变为H2SO4型和HNO3型雨水降落而形成的。我省主要是硫酸型酸雨。我省这种酸雨形成过程有两种途径:一种是SO2在空气中的飘尘做催化剂的作用下被氧气氧化为SO3,溶于水生成硫酸,写出有关的反应化学方程式 、 ;
另一种是SO2溶于水生成亚硫酸,再被空气中的氧气氧化成硫酸,写出有关的反应化学方程式 、 。由于SO2的氧化非常缓慢,故后一种途径是其主要形成过程。
(3)兴趣小组同学取刚降到热电厂附近的雨水进行测定,每隔五分钟测一次pH,其数据如下表所示:
| 测定时刻 | 5∶05 | 5∶10 | 5∶15 | 5∶20 | 5∶25 | 5∶30 | 5∶35 |
| pH | 4.95 | 4.94 | 4.94 | 4.88 | 4.86 | 4.85 | 4.85 |
分析上述数据变化,你可以得出的结论是 ;针对此结论,你猜测其中的原因为 。结合大理石被酸雨腐蚀的事实,你认为碳酸、硫酸、亚硫酸酸性由强到弱的顺序为__________________________。
(二)SO2气体能使品红溶液、高锰酸钾溶液褪色。

回答以下问题:
(1)单独检查装置C的气密性的操作是:关闭活塞b,然后________________________ ,
若发现________________,说明装置C气密性良好。
(2)实验室用Na2SO3固体和硫酸溶液制取SO2气体,应选用__________(选“A”或“C”)做气体发生装置,不选用另一装置的理由是 。
(3)小组的同学在A、C装置中的另一个用块状FeS固体和稀硫酸制取H2S气体,反应的方程式为_________________ 。
(4)SO2气体通过D装置时现象是____________________ ,通过E装置时现象是________________ ;SO2与H2S在B装置中反应,生成一种氧化物和一种单质,反应的方程式是 。
(5)F仪器的名称是___________;F中盛有NaOH固体,作用是
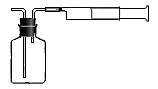
(三)⑴为测定某地方的空气中SO2和可吸入颗粒的含量,查阅资料得知:可用含有一定量碘的溶液测定空气中的SO2含量,反应方程式是:SO2+I2+2H2O=H2SO4+2HI。甲同学设计了如下图所示的实验装置:

①应用上述装置测定空气中的SO2含量和可吸入颗粒的含量,除测定气体流速(单位:cm3/min)外,还需要测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量和 。
②已知:碘单质微溶于水,KI可以增大碘在水中的溶解度。
请你协助甲同学完成稀碘溶液的配制:
第一步:准确称取1.27g碘单质加入烧杯中, ;
第二步:加适量水使之完全溶解,然后加水至溶液体积为1000 mL;
第三步:从第二步所得溶液中,取出10.00mL溶液加入稀释至100mL。
⑵乙同学拟用下列简易装置测定空气中的SO2含量:准确取50mL第三步所得的碘溶液,注入右图所示广口瓶中,加2~3滴淀粉指示剂,此时溶液呈蓝色。在指定的测定地点抽气,每次抽气100mL,直到溶液的蓝色全部褪尽为止,记录抽气次数(n)。
假设乙同学的测量是准确的,乙同学抽气的次数为80次,计算说明该地空气中的SO2含量是否符合排放标准。(写出解题过程,此题3分)

⑶该小组同学认为这些工厂要对排出的废气进行处理,为了达到最好效果,在实验室进行了实验模拟,你认为他们为了吸收产生的SO2气体,所使用药品应该是________,发生的化学反应方程式______________________________________
经过再三思考,设计了以下装置,认为下列哪种不能采用______,因为其他装置都具有________作用。

A B C D E F G H I J
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com