
题目列表(包括答案和解析)
| 元素 | X | Y | Z | V | W |
| 性质 信息 |
单质为有色气体,有毒,可用于自来水消毒 | 日常生活中常见金属,熔化时并不滴落,好象有一层膜兜着 | 其单质在空气中约占4/5左右 | 单质为淡黄色晶体,质脆,不溶于水,微溶于酒精 | 位于第IVA,是形成的化合物最多的元素之一 |


| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |

| ||
| ||




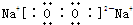
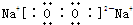
| 1 |
| 2 |
| 1 |
| 2 |
| 键能(kJ/mol) | 键能(kJ/mol) | 键能(kJ/mol) | |||
| H-H | 436 | C-Cl | 243 | H-Cl | 432 |
| Cl-Cl | 330 | C-I | 218 | C-F | 427 |
| C-O | 347 | H-O | 464 | H-F | 565 |
| 选项 | 现象:沸点H2O>H2S | 原理:键能H-O>H-S | 原理对现象的解释 |
| A | 正确 | 正确 | 可以 |
| B | 错误 | 正确 | |
| C | 正确 | 错误 | |
| D | 正确 | 正确 | 不可以 |
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
B
A
D
B
B
A
D
B
C
C
二、选择题
题号
11
12
13
14
15
答案
C
CD
CD
A
D
三、填空、简答和计算
16. H、Li;(2)Li,F;(3)HF
17.(1)Na;(2)Ar;(3) ;NaOH;
;NaOH; ;(4)Na;
;(4)Na;
18.(1)1;(2) +5;(3)7?
19.(1)0.93<x(Mg)<1.57, 2.25<x(N) <3.44 (每空1分)
(2)原子半径越小X值越大.(2分) (3)x值越大元素的非金属性越强.(4)x(K)<x(Na).
20.⑴A:Mg;B:Al;C:Cl;D:C。⑵ 略。⑶现象是产生白色沉淀,后沉淀部分溶解 。
化学反应方程式为 AlCl3+3NaOH=Al(OH)3+3NaCl,Al(OH)3+NaOH==NaAlO2+2H2O
,质量为
21.①从Cl→1,单质与H2化合逐渐变难,生成卤化氢的稳定性HCl>HBr>HI。
②氯可以把溴和碘分别从溴化物和碘化物中置换出来,溴可以把碘从碘化物中置换出来,但溴不能把氯从氯化物中置换出来。
③(结论):从Cl→1元素非金属性逐渐减弱,说明同一主族元素从上到下,随原子序数增加,元素非元素性逐渐减弱。
22.解:设R的原子序数为a,则有:2y-x+z=8(1),16y+x-z=64(2),8y+x-R=16(3)。
联立(1)、(2)、(3)得:a-x=16,当x=
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com