
题目列表(包括答案和解析)
海洋是卤素资源的宝库,如99%以上的溴来自海洋,碘也主要分布在海洋中。
(1)卤素原子的最外层电子的轨道表示式可写为_____________,其中氟原子的核外电子的运动状态共有
______种。
(2)用一个离子方程式表示卤素比同周期的氧族元素的非金属性强:___________________。
(3)下列关于卤素及其化合物性质的说法正确的是____。
A.氯气能置换出溴化钾溶液中的溴,故氟气也能置换出氯化钠溶液中的氯
B.氟化氢比其他卤化氢稳定,是因为氟化氢分子间作用力大
C.实验室一般用浓磷酸与溴化钾固体加热来制取溴化氢气体
D.氟化氢,氯化氢、溴化氢、碘化氢的颜色依次变深
(4)酸的强弱除本性外,还与溶剂有关。例如,HF在水溶液中部分电离,但在液氨中全部电离,这种效应称为拉平效应。根据上述原理,如果要比较HCl,HBr、HI的酸性强弱,应测定它们在____(填“醋酸”“液氨”或“水”)中的电离度。
(5)已知铵盐受热分解的过程就是铵根离子把氢离子(质子)转移给酸根离子的过程,那么卤素离子与铵根离子形成的铵盐中最不稳定的是___________ (写化学式)。
(1)铵盐受热分解的过程就是铵根离子(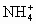 )把质子转移给酸根的过程.对于相同类型的铵盐,可根据上述反应判断其热稳定性.NH4F,NH4Cl,NH4Br,NH4I的热稳定性由强到弱的顺序应为________,理由是________.
)把质子转移给酸根的过程.对于相同类型的铵盐,可根据上述反应判断其热稳定性.NH4F,NH4Cl,NH4Br,NH4I的热稳定性由强到弱的顺序应为________,理由是________.
(2)在短周期元素中,X,Y两元素形成的化合物XY2中共有38个电子;若XY2是离子化合物,其化学式是________,若XY2是共价化合物,其化学式是________.
| ||
| ||
| 温度 | 10℃ | 20℃ | 30℃ | 40℃ |
| 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
| 碳酸氢铵 | 15.8 | 21.0 | 27.0 | 分解 |
| 碳酸氢钠 | 8.1 | 9.6 | 11.1 | 12.7 |
| 氯化铵 | 33.3 | 37.2 | 41.4 | 45.8 |
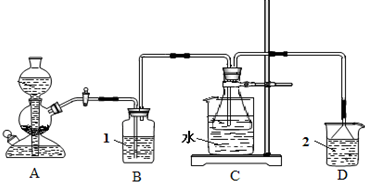
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
C
D
A
B
A
B
D
B
D
B
二、选择题
题号
11
12
13
14
15
答案
D
C
BD
C
B
三、填空、简答和计算
16.(1)酒精或氢氧化钠溶液 (2)稀盐酸或稀硝酸 (3)浓盐酸
17.(1)生成淡黄色沉淀 (2)分层,下层橙红色 (3)生成白色沉淀
18. Cl2、Br2、I2、HClO; KCl、I2; KCl
19.(1)
MnO2+ 4HCN  Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
Mn(CN)2+(CN)2↑+2H2O(2)(CN)2+2KOH==KCN+ KCNO+ H2O
20.(1)NH4I>NH4Br>NH4Cl>NH
21. HCl MnO2 Cl2 KBr KCl Br2 KI I2 AgBr
22.(1)2I-+Cl ====2Cl-+I
====2Cl-+I (2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
(2)BD;四氯化碳不溶于水、碘在其中有较好的溶解度、且四氯化碳易挥发;分层,下层为紫红色,上层近于无色。(3) 使漏斗内外空气相通,以保证漏斗里液体能流出;使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不要让上层液体流出;(4)蒸馏
23.设参加反应的Cl2的质量为x,
2NaI+Cl2==2NaCl+I
300 71 117 300-117
x
 x=
x=
答:有
24.解:Cl2+2KBr=2KCl+Br2 ∵K+:Cl-=2:1
∴KBr过量有剩余且生成的KCl物质的量等于KBr剩余的物质的量。
又∵Br元素
则:KBr剩余0.125mol,生成KCl0.125mol
(1)V(Cl)2 = (2)
(2)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com