
题目列表(包括答案和解析)
| c(B) |
| c(C) |
| cp(C) |
| cm(A)?cn(B) |
| cp(C) |
| cm(A)?cn(B) |
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
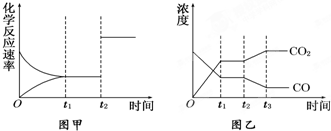
 现有反应X(g)+Y(g)?2Z(g)△H<0.下图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡.则在图中t2s时改变的条件可能是( )
现有反应X(g)+Y(g)?2Z(g)△H<0.下图表示从反应开始到t1s时达到平衡,在t2s时由于条件变化使平衡破坏,到t3s时又达平衡.则在图中t2s时改变的条件可能是( )
9.C 10.B 11.A 12.A 13.D 14.D 15.C
28 (13分)
(1) HNO3 NH3 .files/image024.gif) H2O NH4NO3 (3分)
H2O NH4NO3 (3分)
(2)2Al+2OH- +6H2O=====2[Al(OH)4]- +3H2 Ó 或2Al+2OH- +2H2O====2AlO2- +3H2Ó(2分);
(3)I.<(2分) II K1/K2;66.67%(4分)
(4)N2+8H+ +6e- =======2NH4+(2分)
29.(15分)
(1)①NaNO2(2分);0.8(2分 ) ②b、c(2分 )
(2)①Fe3+>Cu2++>Fe2+(2分)
②方案:将铜棒与碳棒用导线连接,再插入氯化铁溶液,发现有电流产生(3分)
(3)①Cu2+、Fe2+(2分)
②1.0.files/image026.gif) 10-17(mol
10-17(mol.files/image024.gif) L-1)3(2分)
L-1)3(2分)
30(14分)
(1) C(2分)
(2) 避免 Na2SO3==== Na2S+ 2 Na2SO4(2分)
(3)
4 Na2SO3.files/image029.gif) 3
Na2SO4(2分)
3
Na2SO4(2分)
(4)
实验③的溶液中可能有Na2S,相同条件下,S2-水解程度大于SO2-3,的溶液的碱性强,pH增大(2分);S2-+H2O.files/image009.gif) HS-+HO-(2分)
HS-+HO-(2分)
(5)
取 ③溶液适量于试管中,向其中加稀H2SO4,如有腐蛋气味气体生成,则证明有S2-(或向其中加新制氯水,如有浑浊出现,则证明有S2-)(2分),另取③中溶液适量于试管中,加入HCL酸化的BaCL2溶液,如有白色沉淀 证明SO2-4.files/image031.gif) 38(8分)
38(8分)
31.(8分)
(1) 苯环,醛基(1分);
(2) D(1分)
(3)
.files/image032.gif)
(4)4分(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com