
题目列表(包括答案和解析)
aA(g)+bB(g)![]() cC(g)+dD(g)反应达到平衡时,瞬时速率
cC(g)+dD(g)反应达到平衡时,瞬时速率![]() 为速率常数),又
为速率常数),又![]() 为化学平衡常数).在2L体系中加入4 mol SO2和2 mol O2且500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
为化学平衡常数).在2L体系中加入4 mol SO2和2 mol O2且500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
(1)起始时正反应速率是平衡时的_________倍.
(2)在500℃时该反应的平衡常数k2是_________.
(3)在温度不变时再向平衡体系中加入2 mol SO2、2 mol O2和4 mol SO3,平衡将向_________移动.
反应aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a∶b∶c为________。
(2)A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________。
(3)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是__________________________。
(4)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低: T2________T3(填“>”、“=”、“<”),判断的理由是__________________________。
(5)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第Ⅳ阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。

反应aA(g)+bB(g)![]() cC(g)(ΔH<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行.改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
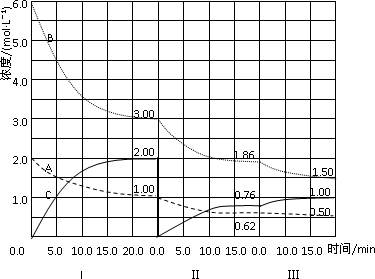
回答问题:
(1)反应的化学方程式中,a∶b∶c为________;
(2)A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为________;
(3)B的平衡转化率αI(B)、αⅡ(B)、αⅢ(B)中最小的是________,其值是________;
(4)由第一次平衡到第二次平衡,平衡移动的方向是________,采取的措施是________;
(5)比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2________T3(填“>”“<”“=”),判断的理由是________;
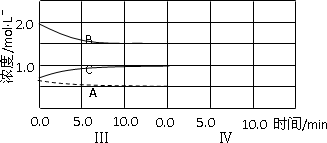
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10 min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
对于反应aA(g)+bB(g)![]() cC(g)+dD(g)反应达平衡时,瞬时速率v正=k1c(A)a·c(B)b(k1为速率常数),达平衡时k2=c(C)c·c(D)d/c(A)a·c(B)b(k2为化学平衡常数),且k1,k2只与温度有关.现将4 mol SO2和2 mol O2充入容器为2 L的密闭容器中,500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
cC(g)+dD(g)反应达平衡时,瞬时速率v正=k1c(A)a·c(B)b(k1为速率常数),达平衡时k2=c(C)c·c(D)d/c(A)a·c(B)b(k2为化学平衡常数),且k1,k2只与温度有关.现将4 mol SO2和2 mol O2充入容器为2 L的密闭容器中,500℃进行反应并保持温度不变,反应达平衡时,SO2转化率为50%,则:
(1)起始时正反应速率是平衡时的________倍.
(2)在500℃时该反应的平衡常数,k2是________.
(3)在温度不变时再向平衡体系中加入2 mol SO2,2 mol O2和4 mol SO3平衡将向________移动.
(9分)(1)1 mol气态钠离子和1mol气态氯离子结合生成1 mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
①下列热化学方程式中,能直接表示出氯化钠晶体晶格能的是____________。
A.Na+(g)+Cl-(g)―→NaCl(s);△Q
B.Na(s)+Cl2(g)―→NaCl(s);△Q1
C.Na(s)―→Na(g);△Q2
D.Na(g)-e-―→Na+(g);△Q3
E.Cl2(g)―→Cl(g);△Q4
F.Cl(g)+e-―→Cl-(g);△Q5
②写出△Q1与△Q、△Q2、△Q3、△Q4、△Q5之间的关系式________________________________________________________________________
(2)可逆反应:aA(g)+bB(g) ??cC(g)+dD(g),取a mol A和b mol B置于V L密闭容器中,2min后,测得容器中A的浓度为x mol·L-1,以物质C的浓度变化来表示这段时间内反应的平均速率应为__________ __。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com