
题目列表(包括答案和解析)
水是生命之源,也是一种常用的试剂。请回答下列问题:
(1)水分子中氧原子在基态时核外电子排布式为 。
(2)H2O分子中氧原子采取的是 杂化。
(3)水分子容易得到一个H+形成水合氢离子(H3O+)。对上述过程的下列描述不合理的是 。
A.氧原子的杂化类型发生了改变 B.微粒的空间构型发生了改变
C.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是______。(请用相应的编号填写)
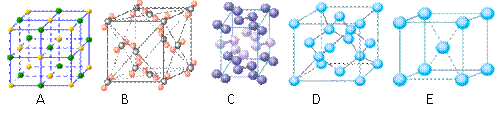 |

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol。
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。请写出生成此配合离子的离子方程式: 。
(08龙岩一中三模)学习化学时会遇到一些与“相等”有关的规律,下列有关“相等”的说法中正确的是()
A.溶液稀释前后,溶质的质量一定相等
B.中和反应中参加反应的酸和碱的质量一定相等
C.微粒中的质子总数和电子总数一定相等
D.物质发生化学变化前后,分子的总数一定相等
| A、中心原子上的孤电子对数为2 | B、O原子采用sp2杂化,空间构型为三角锥形 | C、离子中存在配位键 | D、纯水呈中性,纯水中不存在H3O+微粒 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com