
题目列表(包括答案和解析)
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
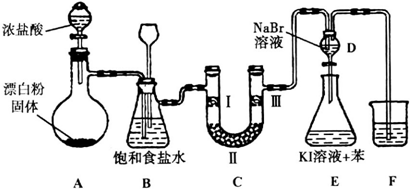
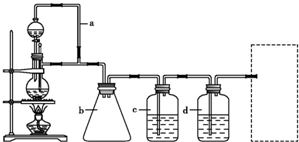
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
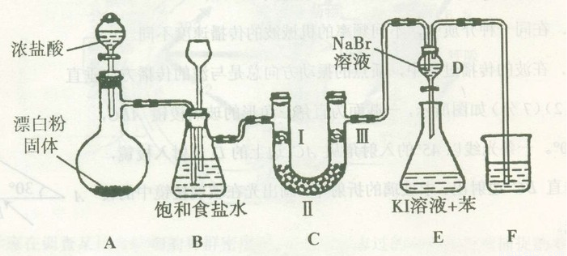
(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:?????????? 。
(2)装置B中饱和食盐水的作用是??????????? ;同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:??????????????? 。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III处依次放入物质的组合应是??????? (填字母编号)。
编号 | I | II | III |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ????????????????????????? ,该现象?????????? (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是???????????? 。
(5)装置F的作用是?????????????????? ,其烧杯中的溶液不能选用下列中的 ???? (填字母编号)。
a.饱和NaOH溶液????? b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液???? d.饱和Na2CO3溶液
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:CH3CH-CH2+CO+H2| 一定条件 |
| H2 |
| Ni,△ |
| 浓H2SO4 |
| △ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com