
题目列表(包括答案和解析)
Ⅰ.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。

(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):
_________________________________________________________。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是___________。
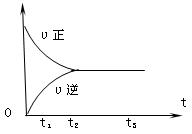
Ⅱ.下图是可逆反应X2+3Y2![]() 2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是________
2Z在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是________

A.t1时,只有正方向反应
B.t2时,反应达到限度
C.t2~t3,反应不再发生
D.t2~t3,各物质的浓度不再发生变化
III.以下是关于化学反应2SO2 + O2 ![]() 2SO3 的两个素材:
2SO3 的两个素材:
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量

素材2:在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数)

从以上的两个素材中体会:
(1)根据素材1中计算20-30s期间,用二氧化硫表示的化学反应的平均速率为: 。
(2)根据素材2中分析得到,提高该化学反应限度的途径有: 。
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件
是 。
 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.
 2SO3 的两个素材:
2SO3 的两个素材:



I.在恒温条件下将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。

(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示): 。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是 。
II.下图是可逆反应X2 + 3Y2 ![]() 2Z2 在反应过程中的反应速率(??)与时间(t)的关系曲线,
2Z2 在反应过程中的反应速率(??)与时间(t)的关系曲线,
下列叙述正确的是
A、t1时,只有正方向反应
B、t2时,反应到达限度
C、t2- t3,反应不再发生
D、t2- t3,各物质的浓度不再发生变化
III.以下是关于化学反应2SO2 + O2 ![]() 2SO3 的两个素材:
2SO3 的两个素材:
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量

素材2:在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数)

从以上的两个素材中体会:
(1)根据素材1中计算20-30s期间,用二氧化硫表示的化学反应的平均速率为: 。
(2)根据素材2中分析得到,提高该化学反应限度的途径有: 。
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是 。
 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中, 2X
2X 2X
2X 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
 2SO3 的两个素材:
2SO3 的两个素材:

一、二选择题(共63分)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
C
D
D
C
A
A
D
题号
10
11
12
13
14
15
16
17
18
答案
B
AD
B
BC
AB
A
BC
AD
D
19、(共12分) (1)增加反应物接触面积,提高反应速率和原料的利用率(2分)
 SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
(2)碳酸锶的溶解度小于硫酸锶的溶解度(1分)
水浴(油浴、液体浴)加热、搅拌(各1分,共2分)
(3)方法一(1分)
(4)ABCD(2分,少答一个扣1分)
20、(共10分)(1)(每空1分)
实验编号
T/K
试管内取用液体
实验目的
①
298
食盐水
(Ⅱ)③
(Ⅲ)④(只要与前面③、④对应即可)
②
298
碳酸水
③
308
食盐水
④
298
植物油
(2) AC (2分)
21、(共12分)方案一:(1)取一片pH试纸放在表面皿(或玻璃片)上,用洁净的玻璃棒蘸取待测液滴到试纸上,当试纸颜色变化稳定后立即与标准比色卡对照。(3分)
(2)方案二:(1)赶走溶液中少量氧气,隔绝氧气;不正确(3分) (2)碱,不正确(2分)
(3)
实验方法
观察到的现象
取上述滴有酚酞的NaOH溶液慢慢加水稀释(或取上述NaOH溶液稀释后再加入酚酞溶液) (2分)
出现红色且不褪去 (2分)
22、(共12分) ⑴MgCl2(熔融)  Mg+Cl2↑ ⑵Na2S
Mg+Cl2↑ ⑵Na2S
⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH-
H2CO3 +OH-
②降低含硫烟气的温度(或减小含硫烟气的流速)
③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-
中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(每空2分,共12分)
23、(共10分) ⑴
 ⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑶A (因c(CO)/c(CO2)=k,只受温度影响)
⑷②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O (每空2分,共10分)
24、(共11分) (1)保护臭氧层 (2分)
(2)①2KHCO3  K2CO3+CO2↑+H2O(2分)
K2CO3+CO2↑+H2O(2分)
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g);△H=―49.5kJ/mol (3分)
(3)Ba(OH)2 (或NaOH和BaCl2混合溶液)(2分) ; 生成沉淀的质量(2分)
25、(共10分)(1)取代反应、加成反应 (每空1分,共2分)
(2)
(2分,缺少乙酸不给分)
(3)C (2分)
(4)R―CH(CH3)OH + CO → R―CH(CH3)COOH (R代表左侧苯环部分) (2分);
(5) (2分)
(2分)
26、(共10分)
(1) CH3CHBrCH3 (1分); (2) 取代反应 (1分)
⑶ (2分)
(2分)
⑷ (2分)
(2分)
(5)HOCH2CH2CH2CHO、CH3CH(OH)CH2CHO或CH3CH2CH(OH)CHO
(CH3)2C(OH)CHO、HOCH2CH(CH2)CHO (写其中任意2个)(每空2分,共4分)
27、(共10分)⑴1s22s22p63s23p63d104s1 ⑵ 1:5
⑶①A、C ②平面正方型 ③9; 1 (每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com