
题目列表(包括答案和解析)
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。
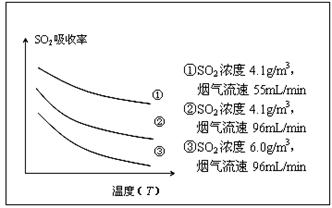
③ 某研究小组为探究提高含硫烟气中SO2的
吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,
有利于提高SO2的吸收效率。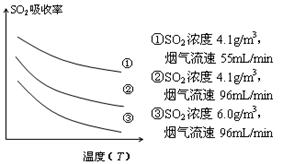
(3)工厂仓库存放的Na2SO3药品已部分被空气
氧化,该化学小组想用已知浓度的酸性KMnO4
溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式___________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是_ (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分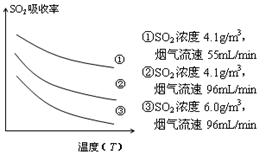
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |






| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式???????????????????????????????? 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入?????????? (选填“Na2S”或“NaOH”)效果更好。
难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(3)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题。利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因????????? (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如图所示。

请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议:??? 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是?????????????????? (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是???????????????????????? 。
Ⅱ.能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式
①2H2(g)+O2(g)=2H2O(l)????  H=-570kJ/mol;
H=-570kJ/mol;
②H2(g)+1/2O2(g)=H2O(g)???  H=-242kJ/mol;
H=-242kJ/mol;
③C(s)+1/2O2(g)=CO(g)????  H=—110.5kJ/moL;
H=—110.5kJ/moL;
④C(s)+O2(g)=CO2(g)???????  H=—393.5kJ/moL;
H=—393.5kJ/moL;
⑤CO2(g)+2H2O(g)=2CH4(g)+2 O2(g)?  H=+890kJ/moL
H=+890kJ/moL
回答下列问题
(1)上述反应中属于吸热反应的是??????????????? 。
(2)H2的燃烧热为△H=??????????????? 。
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)=H2(g)+ CO(g)????  H=akJ/moL;则a=???????? ;该反应的熵
H=akJ/moL;则a=???????? ;该反应的熵 S???????? 0(选填“>”、“=”、“<”);已知自由能
S???????? 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
(4)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是????? 。

A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2—由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
Ⅰ.沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是可持续发展的重要保证。 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

 H=-570kJ/mol;
H=-570kJ/mol; H=-242kJ/mol;
H=-242kJ/mol; H=—110.5kJ/moL;
H=—110.5kJ/moL; H=—393.5kJ/moL;
H=—393.5kJ/moL; H=+890kJ/moL
H=+890kJ/moL H=akJ/moL;则a= ;该反应的熵
H=akJ/moL;则a= ;该反应的熵 S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能 G=
G= H—T
H—T S,当
S,当 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。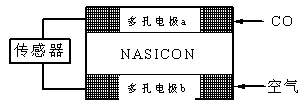
一、二选择题(共63分)
题号
1
2
3
4
5
6
7
8
9
答案
D
B
C
D
D
C
A
A
D
题号
10
11
12
13
14
15
16
17
18
答案
B
AD
B
BC
AB
A
BC
AD
D
19、(共12分) (1)增加反应物接触面积,提高反应速率和原料的利用率(2分)
 SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
SrS+4CO↑(2分) 溶解、过滤(干燥)(2分)。
(2)碳酸锶的溶解度小于硫酸锶的溶解度(1分)
水浴(油浴、液体浴)加热、搅拌(各1分,共2分)
(3)方法一(1分)
(4)ABCD(2分,少答一个扣1分)
20、(共10分)(1)(每空1分)
实验编号
T/K
试管内取用液体
实验目的
①
298
食盐水
(Ⅱ)③
(Ⅲ)④(只要与前面③、④对应即可)
②
298
碳酸水
③
308
食盐水
④
298
植物油
(2) AC (2分)
21、(共12分)方案一:(1)取一片pH试纸放在表面皿(或玻璃片)上,用洁净的玻璃棒蘸取待测液滴到试纸上,当试纸颜色变化稳定后立即与标准比色卡对照。(3分)
(2)方案二:(1)赶走溶液中少量氧气,隔绝氧气;不正确(3分) (2)碱,不正确(2分)
(3)
实验方法
观察到的现象
取上述滴有酚酞的NaOH溶液慢慢加水稀释(或取上述NaOH溶液稀释后再加入酚酞溶液) (2分)
出现红色且不褪去 (2分)
22、(共12分) ⑴MgCl2(熔融)  Mg+Cl2↑ ⑵Na2S
Mg+Cl2↑ ⑵Na2S
⑶①CO32-+H2O HCO3-+OH-(或2H2SO4)或 HCO3-+H2O
HCO3-+OH-(或2H2SO4)或 HCO3-+H2O H2CO3 +OH-
H2CO3 +OH-
②降低含硫烟气的温度(或减小含硫烟气的流速)
③2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42-
中和、稀释经氧气氧化后海水中生成的酸(H+),减少污染。(每空2分,共12分)
23、(共10分) ⑴
 ⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑵66.7%或66.67% 作图要点:①起点(0,0.75) ②平衡点(8之后,0.25) ③走势逐渐减小(下弧线);(根据等效平衡理论或K计算)
⑶A (因c(CO)/c(CO2)=k,只受温度影响)
⑷②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O (每空2分,共10分)
24、(共11分) (1)保护臭氧层 (2分)
(2)①2KHCO3  K2CO3+CO2↑+H2O(2分)
K2CO3+CO2↑+H2O(2分)
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g);△H=―49.5kJ/mol (3分)
(3)Ba(OH)2 (或NaOH和BaCl2混合溶液)(2分) ; 生成沉淀的质量(2分)
25、(共10分)(1)取代反应、加成反应 (每空1分,共2分)
(2)
(2分,缺少乙酸不给分)
(3)C (2分)
(4)R―CH(CH3)OH + CO → R―CH(CH3)COOH (R代表左侧苯环部分) (2分);
(5) (2分)
(2分)
26、(共10分)
(1) CH3CHBrCH3 (1分); (2) 取代反应 (1分)
⑶ (2分)
(2分)
⑷ (2分)
(2分)
(5)HOCH2CH2CH2CHO、CH3CH(OH)CH2CHO或CH3CH2CH(OH)CHO
(CH3)2C(OH)CHO、HOCH2CH(CH2)CHO (写其中任意2个)(每空2分,共4分)
27、(共10分)⑴1s22s22p63s23p63d104s1 ⑵ 1:5
⑶①A、C ②平面正方型 ③9; 1 (每空2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com