
题目列表(包括答案和解析)
在一固定容积的密闭容器中进行如下反应:2SO (g)+O
(g)+O (g)
(g) 2SO
2SO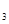 (g),已知反应进行到10秒时,SO
(g),已知反应进行到10秒时,SO 、O
、O 、SO
、SO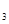 的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
A.10秒时,用O 表示该反应的平均反应速率为0.01 mol/(L·s) 表示该反应的平均反应速率为0.01 mol/(L·s) |
B.当反应达平衡时,SO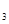 的物质的量可能为0.4 mol 的物质的量可能为0.4 mol |
C.当SO 和O 和O 的生成速率之比为2:1时,达到该反应限度 的生成速率之比为2:1时,达到该反应限度 |
D.向容器内充人SO ,可以提高反应速率 ,可以提高反应速率 |
 (g)+O
(g)+O (g)
(g) 2SO
2SO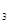 (g),已知反应进行到10秒时,SO
(g),已知反应进行到10秒时,SO 、O
、O 、SO
、SO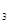 的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是A.10秒时,用O 表示该反应的平均反应速率为0.01 mol/(L·s) 表示该反应的平均反应速率为0.01 mol/(L·s) |
B.当反应达平衡时,SO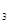 的物质的量可能为0.4 mol 的物质的量可能为0.4 mol |
C.当SO 和O 和O 的生成速率之比为2:1时,达到该反应限度 的生成速率之比为2:1时,达到该反应限度 |
D.向容器内充人SO ,可以提高反应速率 ,可以提高反应速率 |

| ||
| ||
| ||
| ||
运用化学反应原理研究元素及其化合物的反应对生产、生活有重要意义。
请回答下列问题:
(1)工业上以辉铜矿(主要成分 Cu2S)为原料,采取火法熔炼工艺生产铜。该过程中有如下反应:
2Cu2S(s)+3O2(g)=2Cu2O(s)十2SO2(g) △H=-768.2KJ·mol-1
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0KJ·mol-1
则反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的 △H= 。
 (2)硫酸生产中涉及反应:2SO
(2)硫酸生产中涉及反应:2SO![]() (g)+O
(g)+O![]() (g)
(g)![]() 2SO
2SO![]() (g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
(g)。 ① 一定条件下,的平衡转化率和温度的关系如右图所示。该反应的ΔH O(填“>”或“<”)。反应进行到状态D时,v正 v逆(填“>”、“<”或“=”)。
② 某温度时,将4molSO2和2molO2通入2L密闭容器中,10min时反应达到平衡状态,测得SO3的浓度为1.6mol·L-1,则0~10min内的平均反应速率v(SO2)= ,该温度下反应的平衡常数K= 。
③ 下列叙述能证明该反应已经达到化学平衡状态的是(填标号,下同)
A.容器内压强不再发生变化 B.SO![]() 的体积分数不再发生变化
的体积分数不再发生变化
C.容器内气体质量不再发生变化 D.容器内气体密度不再发生变化
④ 以下操作将引起平衡向正反应方向移动并能提高SO![]() 转化率的是
转化率的是
A.向容器中通入少量O![]() B.向容器中通入少量SO
B.向容器中通入少量SO![]()
C.使用催化剂 D.升高温度 E.恒容通入少量氦气
⑤ 气体SO2是大气污染物,可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨
题号
1
2
3
4
5
6
7
8
答案
A
D
D
B
B
D
B
B
题号
9
10
11
12
13
14
15
16
答案
D
D
B
D
C
D
C
D
17.(1)Fe及Fe后两纵行涂黑(1分)

 (2)∶Li?+?H → Li+[H∶] (2分)
(2)∶Li?+?H → Li+[H∶] (2分)
(3)①硫在SF 中显+6价不可再升,O
中显+6价不可再升,O 不可将负一价氟氧化。(2分)
不可将负一价氟氧化。(2分)
正八面体(1分)
|