
题目列表(包括答案和解析)
(10分)2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
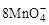 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
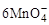 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______![]() +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
8![]() +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6![]() +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1 (NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
___![]() +_____Fe2++______H+====______Mn2++______Fe3++______H2O
+_____Fe2++______H+====______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_________ mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2?·6H2O(M=
(4)混合物中Cu2S的质量分数为_________。
(10分)2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
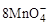 +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
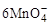 +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______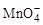 +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
(10分)欲配制500 mL 0.5 mol/L的NaOH溶液,试回答下列问题.
(1)计算:需要NaOH固体的质量为______________.
(2)某学生用托盘天平称量小烧杯的质量(烧杯中盛NaOH),称量前把游码放在标尺的零刻度,天平静止时发 现指针在分度盘的偏右位置,此时左边的托盘将____________(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为____________.假定最终称量小烧杯的质量为________(填“32.6 g”或“32.61 g”).
现指针在分度盘的偏右位置,此时左边的托盘将____________(填“高于”或“低于”)右边的托盘,欲使天平平衡,所进行的操作为____________.假定最终称量小烧杯的质量为________(填“32.6 g”或“32.61 g”).
(3)在标尺(图)上画出游码位置(画“△”表示).
8MnO![]() +5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+====10Cu2++5SO2+8Mn2++22H2O
6MnO![]() +5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+====5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,
剩余的KMnO4恰好与350 mL 0.1 mol/L (NH4)2Fe(S04)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
![]() MnO
MnO![]() +
+![]() Fe2++
Fe2++![]() H+==
H+==![]() Mn2++
Mn2++![]() Fe3++
Fe3++![]() H2O
H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为_______mol。
(3)欲配制500 mL 0.1 mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392 g/mol)的质量为______g。
(4)混合物中Cu2S的质量分数为_______。
题号
1
2
3
4
5
6
7
8
答案
A
D
D
B
B
D
B
B
题号
9
10
11
12
13
14
15
16
答案
D
D
B
D
C
D
C
D
17.(1)Fe及Fe后两纵行涂黑(1分)

 (2)∶Li?+?H → Li+[H∶] (2分)
(2)∶Li?+?H → Li+[H∶] (2分)
(3)①硫在SF 中显+6价不可再升,O
中显+6价不可再升,O 不可将负一价氟氧化。(2分)
不可将负一价氟氧化。(2分)
正八面体(1分)
|