
题目列表(包括答案和解析)
(2008?佛山一模)根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是( )
|
(8分)卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。以卤块为原料制取轻质氧化镁的工艺流程如下:
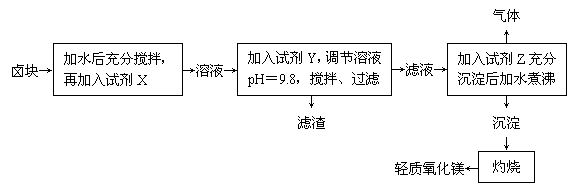
若要求产品中尽量不含有杂质,且生产成本较低,请根据下表中提供的资料,回答下列问题:
表1 生成氢氧化物沉淀的pH
物质 | 开始沉淀时的pH | 沉淀完全时的pH |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
Fe2+氢氧化物呈絮状,不易从溶液中除去,故常将它氧化成Fe3+,生成Fe(OH)3沉淀除去。
表2 原料价格表
物质 | 价格/元?吨-1 |
漂液(含25%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
⑴试剂X最好是 ,加入X的作用是 。
⑵调节pH=9.8的目的是 。
⑶加入试剂Z后发生的离子反应方程式为 。
⑷ 生产中产生的气体是CO2,写出产生CO2的化学方程式 。
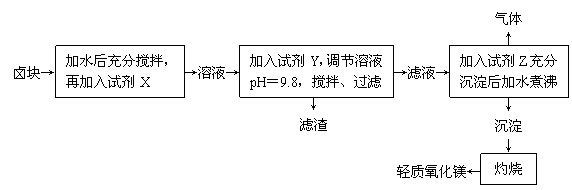 (8分)卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。以卤块为原料制取轻质氧化镁的工艺流程如下:
(8分)卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子。以卤块为原料制取轻质氧化镁的工艺流程如下:
若要求产品中尽量不含有杂质,且生产成本较低,请根据下表中提供的资料,回答下列问题:
表1 生成氢氧化物沉淀的pH
| 物质 | 开始沉淀时的pH | 沉淀完全时的pH |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6☆ |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
☆ Fe2+氢氧化物呈絮状,不易从溶液中除去,故常将它氧化成Fe3+,生成Fe(OH)3沉淀除去。
表2 原料价格表
| 物质 | 价格/元·吨-1 |
| 漂液(含25%NaClO) | 450 |
| 双氧水(含30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
⑴试剂X最好是 ▲ ,加入X的作用是 ▲ 。
⑵调节pH=9.8的目的是 ▲ 。
⑶加入试剂Z后发生的离子反应方程式为 ▲ 。
⑷ 生产中产生的气体是CO2,写出产生CO2的化学方程式 ▲ 。
请根据工业制硫酸的有关知识回答下列问题:
|
(2)在硫酸工业生产中,为了有利于SO2的转化,且能充分利用热能,
采用了中间有热交换器的接触室(见右图)。按此密闭体系中气体
的流向,则在R处流出的气体中除N2外的主要组成为(填序号)
A.SO2 B.SO2、SO4
C.SO2、O2 D.SO3、O2、SO2
|
|
根据下表中的数据判断下列图像正确的是(填序号)
|
SO2转化率 温度 | P1 | P2 |
| 400℃ | 99.6 | 99.7 |
| 500℃ | 96.9 | 97.8 |
|
|
根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是( )
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 分子式 | CH4 | C2H4 | C3H8 | C4H8 | C5H12 | C6H12 |
| C8H16 |
A. 6 B. 7 C. 8 D. 9
说明:1. 文字简答题以关键词到位为准,按点给分;
2. 化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3. 写名称或化学式正确的正常给分; 4. 其他合理解法正常给分。
第Ⅰ卷(选择题,共48分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
二、选择题(本题包括6小题,每小题4分,共24分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
A
C
D
B
D
D
A
C
A
AD
A
C
BD
D
第Ⅱ卷(非选择题 共72分)
三、(本题包括2小题,共18分)
15.(12分)(1)过滤(2分) 蒸发、结晶(2分) (2)从漏斗向量气筒内注入一定量的水,连接好装置,移动漏斗形成液面高度差,静置后,液面高度不再变化,即表明气密性良好。(其他合理方法均给分)(2分)
(3)移动漏斗保持液面与量气筒液面相平,防止试管和量气筒内气体压强过大 (4分,各2分)
(4) %(2分)
%(2分)
16.(6分,各2分)(2)向上述刚好褪色的溶液中再滴入一些NaOH溶液,若红色复出,则是因为HCl和HClO的酸性所致,甲正确;若红色不再复出,则是因为HClO的强氧化性所致,乙正确。
(3)在试管中注入滴有酚酞的氨水,加热试管,观察溶液颜色变化,如果颜色变浅,则加热使氨水中的c(OH一)减小,乙正确;如颜色变深,则加热使氨水中的c(OH一)增大,甲正确。
(4)向Mg(OH)2沉淀中加入中性的醋酸铵浓溶液,加入后若Mg(OH)2不溶解,甲正确;加入后若Mg(OH)2溶解,则乙正确。
四、(本题包括2小题,共22分)
17.(12分,每空2分)(1)
(2)减小 , OH―中和了反应中的H+,有利于平衡向右进行,提高CuCl的产率。但当OH―浓度过大时,Cu+能与OH-结合,生成氢氧化亚铜,从而降减了CuCl的产率。
注此答案同题目不一致
(3)
(4)反应①在隔绝空气条件下进行。
18.(10分,每空2分)
(1)6(NH2)2CO → C3H6N6 + 6NH3 + 3CO2、4NO2 + O2+2H2O = 4HNO3、 CO2+4H2→CH4 +2H2O
(2)66.7% (3)做耐磨材料等。
五、(本题包括1小题,共12分)
19.(12分)
(1)Fe-6e-+8OH-ㄔFeO42-+4H2O(2分)
(2)铁丝网的接触面积更大。(2分)因为铁电极上发生析氧反应4OH--4e-ㄔO2↑+2H2O,氧气将铁氧化而得到氧化铁膜。(也可以直接写电极反应式或综合式:6OH--6e-+2FeㄔFe2O3+3H2O)(2分)
(3)ACD(2分,对1―2个给1分,全对得2分,错1个扣1分)
(4)升温电解一方面加快了高铁酸盐的生成速率,另一方面又加速FeO42-的分解,10~
(5)BCD(2分,对1―2个给1分,全对得2分,错1个扣1分)
六、(本题包括1小题,共10分)
20.(10分)(1)BD (2分,对1个得1分,多选1个扣1分,扣完为止) (2)小于,减小 (2分)
(3)不,1.0(4分,各2分) (4)56(2分)
七、(本题包括1小题,共10分)
21.(10分)(1)2Cl―+2H2O=2OH―+Cl2↑+H2↑(2分)
(2)A(2分)
(3)n(H2)= n(已电解NaCl)=500
mol´2=1000
mol(1分)
n(已电解NaCl)=500
mol´2=1000
mol(1分)
n(总NaCl)=1000
/0.9 mol m(总NaCl)=
1000 /0.9 mol´
m(NaCl溶液)=
(4)由n(H2)=500 mol得:n(CH4)= 500 mol´2/8=125 mol(2分)
V(CH4)= 125 mol ´
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com