
题目列表(包括答案和解析)
海水淡化可采用膜分离技术。如下图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是( )
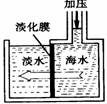
A.溶质质量增加 B.溶液质量不变 C.溶剂质量减少 D.溶质质量分数减少
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。

①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答:

①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。
水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前,_______ 和_______是主要的去离子方法。
(2)根据废水中所含有害物质的不同,工业上有多种废水的处理方法。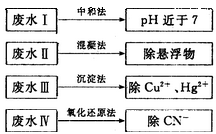
①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为________。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+。我国规定,Hg2+的排放标准不能超过0. 05 mg/L。若某工厂排放的废水1L中含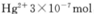 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用Cl2氧化CN-成CO2和N2。,若参加反应的Cl2与CN-的物质的量之比为5:2,则该反应的离子方程式为____________
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交换的CaR2(或MgR2)型树脂置于_______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,如图是海水中利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答: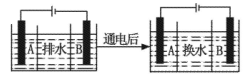
①阳离子交换膜是指____(填“A”或“B”)。②写出通电后阳极区的电极反应式____。

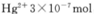 ,是否达到了排放标准_______(填“是”或“否”)。
,是否达到了排放标准_______(填“是”或“否”)。
【化学——选修2:化学与技术】(15分)
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业。请回答下列问题。
(1)列举两种海水淡化的方法:_________、_________。
(2)氯碱工业通过电解饱和食盐水能获得烧碱和氯气等物质,该反应的化学方程式为_____________,如图是用离子交换膜法电解饱和食盐水的原理示意图。其中石墨接电源_________极,电解时铁电极的电极反应式为_________。电解过程中通过离子交换膜的主要离子是__________。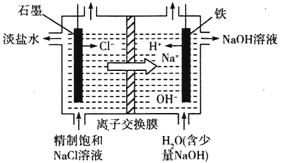
(3)侯氏制碱法中,首先向饱和食盐水中通入CO2和NH3制备NaHCO3,其化学方程式为____________;先通入的是__________(填化学式),其理由是__________________ ;再利用NaHCO3受热分解可制备纯碱。
(4)目前世界上60%以上的镁都是从海水中提取的,已知:MgO和MgCl2的熔点分别为2852℃和714℃。分析说明工业上采用电解熔融MgCl2而不是电解熔融MgO的理由__________ ______________________________________________________________________ 。
一、选择题(本题包括20小题,1―10题每题2分,11―20题每题3分,共50分。每小题只有一个选项符合题意)
1―5 DCBBA 6―10 CBCCB 11―15 BDCAD 16―20 DAADA
二、(本题包括3小题,共21分)
21.(6分)
(1)KOH(1分)
(2)Ar K+(Ca2+、HS-、S2-、 ) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
) F2 HCl(N2H4、SiH4、PH3、H2S、H2O2、CH3OH) 【错的倒扣分,多写的同类重复的不倒扣分】(4分)
(3) (1分)
(1分)
22.(10分)
(1)FeCl2 KSCN(或NH4SCN)溶液(2分)
(2)d(2分)
(3) (2分)
(2分)
(4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+增多从而使红色加深(1分)
(5)假设:加入还原剂将Fe3+还原(1分)
用胶头滴管取少量黄色褪色后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水,如果溶液开始不出现红色,加氯水后出现红色,则说明假设正确,若溶液不变红色,则假设不正确。(2分)(有其他合理假设、答案也可酌情得分)。
23.(5分)
(1) (1分)
(1分)
(2)CH3CHO(1分)
(3)HCOOH(1分)
(4)DE(2分)
三、(本题包括2小题,共15分)
24.(10分)
(1)B、E、F、I(4分,多选、漏选、错选一个扣1分,扣完为止)
(2)D(1分)制氯气的D中进气导管应深入集气瓶底,(1分)逸出的氯气应通入盛有烧碱溶液的烧杯中。(1分)
干燥氨气;(1分)
 (2分)
(2分)
25.(5分)
(1) (1分)
(1分)
(2)甲 现象:气球膨胀
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压使气球胀大。(2分)
乙 现象:烧杯内的水流入锥形瓶中
原因:二氧化碳和氢氧化钠溶液反应,使锥形瓶内气体压强减小,大气压将水压入锥形瓶中。(2分)
四、(本题包括2小题,共14分)
26.(8分)
(1)甲基丙烯或2―甲基丙烯  (2分,各1分)
(2分,各1分)
(2)②取代反应(或水解反应) ④消去反应(2分,各1分)
(3)(2分)

(4) (2分,其他合理写法都给分)
(2分,其他合理写法都给分)
27.(6分)
(1)8.0 mol/L(2分)(注意有效数字)
(2) (或
(或 )(2分)
)(2分)
画图(2分)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com